
题目列表(包括答案和解析)
| 电解 |
一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g)![]() FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0
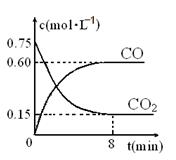
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)= 。
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入少量的CO2,则CO2的转化率将
(填“增大”、“减小”、“不变”)
(4)铁的重要化合物在生产生活中应用十分广泛。
①FeSO4溶液与稍过量的NH4HCO3溶液混合,可得含FeCO3的浊液。若FeCO3浊液长时间暴露在空气中,固体表面会变为红褐色,写出由FeCO3生成红褐色物质的反应的化学方程式: 。
②高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为 。
(5)已知:2CO(g) + O2(g) == 2CO2(g);△H=-566 kJ·mol-1
2H2(g) + O2(g) == 2H2O(g);△H=-483.6 kJ·mol-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式:
。
一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g)FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)= 。
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO2,则CO2的转化率将 (填“增大”、“减小”、“不变”),该反应的平衡常数K= ,温度升高,K (填“增大”、“减小”、“不变”)。
(4)铁的重要化合物在生产生活中应用十分广泛。高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为 。
(5)已知:2CO(g)+O2(g)==2CO2(g)△H=-566 kJ/mol;2H2(g)+O2(g)==2H2O(g)△H=-483.6 kJ/mol。写出CO和H2O(g)作用生成CO2和H2的热化学方程式 。
(6)已知Ksp(Fe(OH)3)= 8´10-38,某溶液中含有Fe3的浓度是0.05mol×L-1。如果要使Fe(OH)3沉淀完全pH至少为 (溶液中离子浓度小于1×10-5mol/L时,沉淀完全,lg2=0.3)
一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g)FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)= 。
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入少量的CO2,则CO2的转化率将
(填“增大”、“减小”、“不变”)
(4)铁的重要化合物在生产生活中应用十分广泛。
①FeSO4溶液与稍过量的NH4HCO3溶液混合,可得含FeCO3的浊液。若FeCO3浊液长时间暴露在空气中,固体表面会变为红褐色,写出由FeCO3生成红褐色物质的反应的化学方程式: 。
②高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为 。
(5)已知:2CO(g) + O2(g)== 2CO2(g);△H=-566kJ·mol-1
2H2(g) + O2(g) == 2H2O(g);△H=-483.6kJ·mol-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式:
。
(13分)一定条件下铁可以和CO2发生反应: Fe(s)+CO2(g)FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)= 。
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO2,则CO2的转化率将 (填“增大”、“减小”、“不变”)
(4)铁的重要化合物在生产生活中应用十分广泛。
①FeCl3溶液可用于天然气脱硫,写FeCl3溶液与天然气中H2S反应的离子方程式:
。
②高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为 。
(5)已知:2CO(g)+O2(g)==2CO2(g) △H=-566 kJ/mol;2H2(g)+O2(g)==2H2O(g) △H=-483.6 kJ/mol。写出CO和H2O(g)作用生成CO2和H2的热化学方程式
。
一、二选择题(共63分)
题号
1
2
3
4
5
6
7
8
9
答案
D
B
C
D
D
C
A
A
D
题号
10
11
12
13
14
15
16
17
18
答案
B
AD
B
BC
AB
A
BC
AD
D
19、(共12分) (1)增加反应物接触面积,提高反应速率和原料的利用率(2分)
 SrS+4CO↑(2分) 溶解、过滤(干燥)(2分)。
SrS+4CO↑(2分) 溶解、过滤(干燥)(2分)。
(2)碳酸锶的溶解度小于硫酸锶的溶解度(1分)
水浴(油浴、液体浴)加热、搅拌(各1分,共2分)
(3)方法一(1分)
(4)ABCD(2分,少答一个扣1分)
20、(共10分)(1)(每空1分)
实验编号
T/K
试管内取用液体
实验目的
①
298
食盐水
(Ⅱ)③
(Ⅲ)④(只要与前面③、④对应即可)
②
298
碳酸水
③
308
食盐水
④
298
植物油
(2) AC (2分)
21、(共12分)方案一:(1)取一片pH试纸放在表面皿(或玻璃片)上,用洁净的玻璃棒蘸取待测液滴到试纸上,当试纸颜色变化稳定后立即与标准比色卡对照。(3分)
(2)方案二:(1)赶走溶液中少量氧气,隔绝氧气;不正确(3分) (2)碱,不正确(2分)
(3)
实验方法
观察到的现象
取上述滴有酚酞的NaOH溶液慢慢加水稀释(或取上述NaOH溶液稀释后再加入酚酞溶液) (2分)
出现红色且不褪去 (2分)
22、(共12分) ⑴MgCl2(熔融)  Mg+Cl2↑ ⑵Na2S
Mg+Cl2↑ ⑵Na2S
⑶①CO32-+H2O HCO3-+OH-(或2H2SO4)或 HCO3-+H2O
HCO3-+OH-(或2H2SO4)或 HCO3-+H2O H2CO3 +OH-
H2CO3 +OH-
②降低含硫烟气的温度(或减小含硫烟气的流速)
③2H2SO3+O2=4H++2SO42-或2HSO3-+O2=2H++2SO42-
中和、稀释经氧气氧化后海水中生成的酸(H+),减少污染。(每空2分,共12分)
23、(共10分) ⑴
 ⑵66.7%或66.67% 作图要点:①起点(0,0.75) ②平衡点(8之后,0.25) ③走势逐渐减小(下弧线);(根据等效平衡理论或K计算)
⑵66.7%或66.67% 作图要点:①起点(0,0.75) ②平衡点(8之后,0.25) ③走势逐渐减小(下弧线);(根据等效平衡理论或K计算)
⑶A (因c(CO)/c(CO2)=k,只受温度影响)
⑷②2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O (每空2分,共10分)
24、(共11分) (1)保护臭氧层 (2分)
(2)①2KHCO3  K2CO3+CO2↑+H2O(2分)
K2CO3+CO2↑+H2O(2分)
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g);△H=―49.5kJ/mol (3分)
(3)Ba(OH)2 (或NaOH和BaCl2混合溶液)(2分) ; 生成沉淀的质量(2分)
25、(共10分)(1)取代反应、加成反应 (每空1分,共2分)
(2)
(2分,缺少乙酸不给分)
(3)C (2分)
(4)R―CH(CH3)OH + CO → R―CH(CH3)COOH (R代表左侧苯环部分) (2分);
(5) (2分)
(2分)
26、(共10分)
(1) CH3CHBrCH3 (1分); (2) 取代反应 (1分)
⑶ (2分)
(2分)
⑷ (2分)
(2分)
(5)HOCH2CH2CH2CHO、CH3CH(OH)CH2CHO或CH3CH2CH(OH)CHO
(CH3)2C(OH)CHO、HOCH2CH(CH2)CHO (写其中任意2个)(每空2分,共4分)
27、(共10分)⑴1s22s22p63s23p63d104s1 ⑵ 1:5
⑶①A、C ②平面正方型 ③9; 1 (每空2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com