
题目列表(包括答案和解析)
(6分)(1)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:
NaBiO3 + MnSO4 + H2SO4===Na2SO4 + Bi2(SO4)3 + NaMnO4 + H2O
①上述反应中还原产物是 ,若有2mol氧化剂在该反应中被还原,则生成的MnO4-被还原为Mn2+时,能将 molHCl氧化成Cl2;
② 写出NaBiO3固体溶于浓盐酸产生黄绿色气体的化学反应方程式 。
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(S)+2H+(aq)=== Cu2+(aq)+H2(g) ΔH=64.39kJ·mol-1
2H2O2(L)===2H2O(L)+O2(g) ΔH=-196.46kJ·mol-1
H2(g)+ O2(g)===H2O(L) ΔH=-285.84kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
(6分)(1)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:
NaBiO3 + MnSO4 + H2SO4===Na2SO4 + Bi2(SO4)3 + NaMnO4 + H2O
①上述反应中还原产物是 ,若有2mol氧化剂在该反应中被还原,则生成的MnO4-被还原为Mn2+时,能将 molHCl氧化成Cl2;
②写出NaBiO3固体溶于浓盐酸产生黄绿色气体的化学反应方程式 。
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(S)+2H+(aq)="==" Cu2+(aq)+H2(g) ΔH=64.39kJ·mol-1
2H2O2(L)===2H2O(L)+O2(g) ΔH=-196.46kJ·mol-1
H2(g)+ O2(g)===H2O(L) ΔH=-285.84kJ·mol-1
O2(g)===H2O(L) ΔH=-285.84kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
(10分)(1)常温下物质的量浓度相同的a HF、b NH3·H2O、c H2S溶液,电离常数分别为7.2ⅹ10-4、5.6ⅹ10-10和K1=9.1ⅹ10-8,K2=1.1ⅹ10-12。
①电解质的强弱顺序为_____________(填a、b、c),②氢离子浓度最小的是___(填a、b、c)。
(2)1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量,由此推知H2SO4与NaOH反应的中和热的热化学方程式为___________________________。
(3)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应△H1、△H2、△H3的大小关系为 。
(4)已知下列反应的反应热:
①CH3COOH(l) + 2O2 (g)= 2CO2 (g)+ 2H2O(l) △H=-870.3kJ∕mol
②C(S) + O2 (g)= CO2 (g) △H=-393.5kJ∕mol
③2C(S) + 2H2 (g) + O2 (g)= CH3COOH(l) △H=-488.3kJ∕mol
请写出H2燃烧热的热化学方程式 。
(10分)(1)常温下物质的量浓度相同的a HF、b NH3·H2O、c H2S溶液,电离常数分别为7.2ⅹ10-4、5.6ⅹ10-10和K1=9.1ⅹ10-8,K2=1.1ⅹ10-12。
①电解质的强弱顺序为_____________(填a、b、c),②氢离子浓度最小的是___(填a、b、c)。
(2)1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量,由此推知H2SO4与NaOH反应的中和热的热化学方程式为___________________________。
(3)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应△H1、△H2、△H3的大小关系为 。
(4)已知下列反应的反应热:
①CH3COOH(l) + 2O2 (g)= 2CO2 (g)+ 2H2O(l) △H=-870.3kJ∕mol
②C(S) + O2 (g)= CO2 (g) △H=-393.5kJ∕mol
③2C(S) + 2H2 (g) + O2 (g)= CH3COOH(l) △H=-488.3kJ∕mol
请写出H2燃烧热的热化学方程式 。
(6分)(1)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:
NaBiO3 + MnSO4 + H2SO4===Na2SO4 + Bi2(SO4)3 + NaMnO4 + H2O
①上述反应中还原产物是 ,若有2mol氧化剂在该反应中被还原,则生成的MnO4-被还原为Mn2+时,能将 molHCl氧化成Cl2;
② 写出NaBiO3固体溶于浓盐酸产生黄绿色气体的化学反应方程式 。
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(S)+2H+(aq)=== Cu2+(aq)+H2(g) ΔH=64.39kJ·mol-1
2H2O2(L)===2H2O(L)+O2(g) ΔH=-196.46kJ·mol-1
H2(g)+ 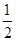 O2(g)===H2O(L) ΔH=-285.84kJ·mol-1
O2(g)===H2O(L) ΔH=-285.84kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com