
题目列表(包括答案和解析)
|
下列说法正确的是 | |
| [ ] | |
A. |
标准状况下,11.2 L臭氧中含氧原子数为6.02×1023 |
B. |
15 g乙烷所含极性共价键的数目为3×6.02×1023 |
C. |
常温下,100 mL 0.1 mol/L醋酸溶液中含醋酸分子为0.01×6.02×1023 |
D. |
一定条件下,2 mol二氧化硫和1 mol氧气混合,反应时转移的电子数为4×6.02×1023 |
(08山东一模)下列说法正确的是 ( )
A.标准状况下,11.2 L臭氧中含氧原子数为6.02×1023
B.15 g乙烷含极性共价键的数目为3×6.02×lO23
C.常温下,100mL O.1mol/L醋酸溶液中含醋酸分子为0.01×6.02×1023
D.一定条件下2 mol二氧化硫和1 mol氧气混合,反应时转移的电子数为4×6.02×1023
设NA表示阿伏加德罗常数的值,下列叙述不正确的是
A.标准状况下,11.2 L三氯甲烷所含分子数为0.5NA
B.常温常压下,1 mol甲基(−CH3)所含电子数为9NA
C.常温常压下,22 g氧气和26 g臭氧混合后,混合气体所含氧原子总数为3NA
D.标准状况下,将22.4 L的NO2通入足量水中发生反应,转移的电子总数为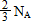
|
设NA表示阿伏加德罗常数的值,下列叙述不正确的是 | |
A. |
标准状况下,11.2 L三氯甲烷所分子数为0.5NA |
B. |
常温常压下,1 mol甲基(-CH3)所含电子数为9NA |
C. |
常温常压下,22 g氧气和26 g臭氧混合后,混合气体所含氧原子总数为3NA |
D. |
标准状况下,将22.4 L的NO2通入足量水中发生反应,转移的电子总数为2/3NA |
|
下列说法正确的是 | |
| [ ] | |
A. |
15 g乙烷所含极性共价键的数目为3×6.02×1023 |
B. |
标准状况下,11.2 L臭氧中含氧原子数为6.02×1023 |
C. |
常温下,100 mL 0.1 mol/L醋酸溶液中含醋酸分子为0.01×6.02×1023 |
D. |
一定条件下,2 mol二氧化硫和1 mol氧气混合,反应时转移的电子数为4×6.02×1023 |
1B
13B 14D
24.(6分)NO2 HCl CO2, Br2(蒸气) NH3, CH4 (各1分)
25.(8分)(1)NaNO2 (1分)0.75mol (2分)(2) ②⑤ (2分)
|