
题目列表(包括答案和解析)
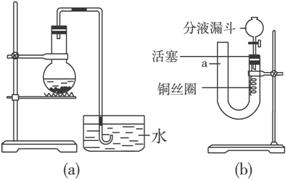
(1)装置(a)能否制取NO______________(填“能”或“不能”)。
(2)为了验证稀硝酸与Cu反应生成的气体是NO气体,如果用装置图(a)进行实验是否可行,为什么?________________________________________________________________。
(3)有人设计了装置图(b)进行实验,证明稀硝酸与Cu反应生成NO气体。请将有关操作补充完全:
将活塞打开,从U形管的长管口a注入稀硝酸,注到____________________________为止。关闭活塞,用酒精灯在______________加热,当______________后,立即撤去酒精灯。
(4)用装置图(b)进行实验时,反应在什么情况下可自动停止?______________。
(5)用装置图(b)进行实验时,如何证明生成的无色气体是NO?______________。
(6)如果要获得浓硫酸跟铜反应与上述稀硝酸跟铜反应的实验形成鲜明对照的效果,应该选择哪套装置__________。(填“装置图(a)”或“装置图(b)”)进行怎样的操作,同时指出实验现象和结论:_______________________________________________________________。
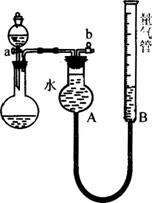
图3-5
(1)进行“铜和稀硝酸反应制取NO”的实验。
①制取NO的化学方程式:__________________________________________________。
②收集气体前必须先____________,然后才开始收集气体。
(2)利用该装置制取并收集少量其他气体,请完成下表:
制取气体 | 药品 |
O2 | _________、___________ |
H2 | __________溶液、Al |
(3)利用该装置进行实验,并根据产生氢气的量来确定某酸的结构:①反应前,先对量气管进行第一次读数。读数时,应注意的操作是____________,并使视线与凹液面最低处相平;反应后,待____________时,再对量气管进行第二次读数。
②实验数据记录如下:(表中读数已折合成标准状况下的数值)
编号 | 酸的质量 | 金属锌的质量 | 量气管第一次读数 | 量气管第二次读数 |
1 | 10. | 40mL | 264mL | |
2 | 1. | 10. | 30mL | 228mL |
3 | 1. | 10. | 20mL | 243mL |
已知该酸的相对分子质量为145。根据上述数据可确定该酸是___________元酸;
③如果第二次对量气管读数时仰视,则所测得的气体体积会___________(填“偏大”、“偏小”或“不能确定”)
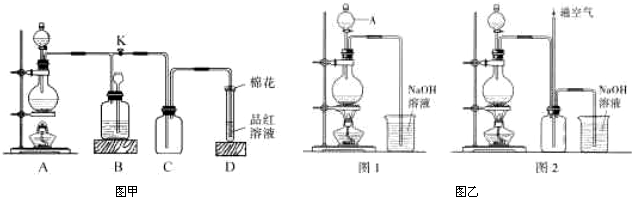

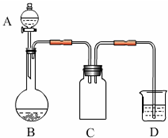 (2012?南京模拟)实验室一般用回收的粗铜屑(含少量Cu2O)与H2SO4、HNO3混合稀溶液反应制备CuSO4?5H2O晶体,反应可在如图所示装置中进行.
(2012?南京模拟)实验室一般用回收的粗铜屑(含少量Cu2O)与H2SO4、HNO3混合稀溶液反应制备CuSO4?5H2O晶体,反应可在如图所示装置中进行.1B
13B 14D
24.(6分)NO2 HCl CO2, Br2(蒸气) NH3, CH4 (各1分)
25.(8分)(1)NaNO2 (1分)0.75mol (2分)(2) ②⑤ (2分)
|