
题目列表(包括答案和解析)
某化学兴趣小组为探索工业废料的再利用,在实验室中用含有铝、铁、铜的合金制取氯化铝溶液、绿矾晶体和胆矾晶体。其实验方案如下:
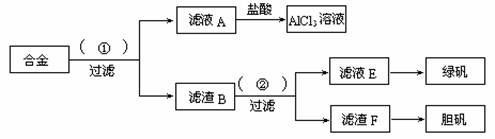
(1)所加试剂①、②分别是_________________________________。
(2)从滤液E中得到绿矾晶体的实验操作是___________________________________;从滤渣F制取胆矾的第一步操作最好采用____________________________。
(3)上述实验方案中,有一步设计明显不合理,请你予以指出,并说明理由__________
_____________________________________________________。你认为正确的设计方案
____________________________________________________________________。
(10分)某化学兴趣小组为探索工业废料的再利用,在实验室中用含有铝、铁、铜的合金制取氯化铝溶液、绿矾晶体(FeSO4?7H2O)和胆矾晶体。其实验方案如下:
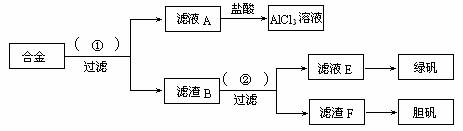
(1)所加试剂①、②分别是 。
(2)从滤液E中得到绿矾晶体的实验操作是 从滤渣F制取胆矾的第一步操作最好采用 。
(3)上述实验方案中,有一步设计明显不合理,请你予以指出,并说明理由 你认为正确的设计方案是 。
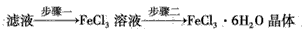
某学校化学兴趣小组为探究金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的AlCl3溶液和胆矾晶体(CuSO4∙5H2O),其实验方案如下:
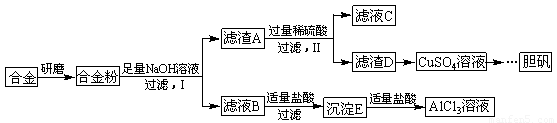
请回答下列问题:
(1)将合金研磨成合金粉的目的是 。
(2)分别写出步骤Ⅰ、Ⅱ中发生反应的化学方程式:
Ⅰ: ;
Ⅱ: 。
(3)在滤液B转化为沉淀E的过程中盐酸的用量不易控制,可将加入适量的盐酸改为通入一种气体,该气体的电子式为 ,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式: 。
(4)该小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣D中加入稀硫酸和H2O2可制得CuSO4,该反应的总化学方程式为 。
某学校化学兴趣小组为探究金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的AlCl3溶液和胆矾晶体(CuSO4?5H2O),其实验方案如下: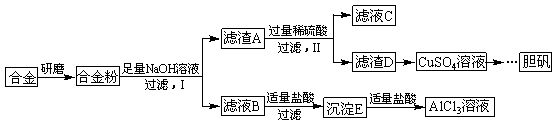
请回答下列问题:
(1)将合金研磨成合金粉的目的是 。
(2)分别写出步骤Ⅰ、Ⅱ中发生反应的化学方程式:
Ⅰ: ;
Ⅱ: 。
(3)在滤液B转化为沉淀E的过程中盐酸的用量不易控制,可将加入适量的盐酸改为通入一种气体,该气体的电子式为 ,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式: 。
(4)该小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣D中加入稀硫酸和H2O2可制得CuSO4,该反应的总化学方程式为 。
选择题
题号
1
2
3
4
5
6
7
8
9
答案
B
D
B
C
A
D
A
A
C
题号
10
11
12
13
14
15
16
17
18
答案
BD
B
B
D
A
B
BD
C
BD
19、(12分)(1)碱性(1分) ClO- + H2O  HClO + OH-
(2分)
HClO + OH-
(2分)
(2)氧化性,漂白性,不稳定性(任写两个,每空1分)
(3)CO2等酸性气体、光和热 (2分)
(4)铁钉表面出现铁锈(或红褐色固体) (1分)
(5)铁钉可能未被腐蚀,也可能被腐蚀但无明显现象 (1分)
用试管取出少量浸泡后的溶液,滴加足量的稀硫酸酸化,再滴加几滴KSCN溶液。(3分)
20、(12分)
实验步骤
实验现象
实验结论(步骤2用离子方程式表示)
2IO3-+5HSO3-=== 3H++5SO42-+H2O+I2 (2分)
该食盐中含有碘元素 (1分)
(2)KIO3在加热或高温下易分解而变质。(1分)
(3)5I-+IO3-+6H+ = 3I2+3H2O (2分) 42.8 (2分) 合格 (1分)
(4)I-+ 3H2O-6e- = IO3-+6H+ (2分) 增大。(1分)
21、(10分)(1)NaOH溶液和稀硫酸(2分)
(2)在隔绝空气的条件下,蒸发浓缩、冷却结晶(2分);将滤渣F在空气中灼烧(1分)
(3)由滤液A制得氯化铝溶液不合理,所得氯化铝溶液中含有大量NaCl杂质。(2分)向滤液A中通入足量的CO2生成Al(OH)3沉淀,过滤,向Al(OH)3沉淀中加入盐酸至沉淀溶解(3分)
22、(14分)
(1)使NO全部转化成HNO3(2分);ABC(2分)
(2)4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905.8kJ/mol (3分)
 (2分)
(2分)
(3)CDE (2分)
(4)30%(或29.9%)(3分)
23、(8分,每空2分)(1)8Fe(OH)2+NO3-+6H2O=8Fe(OH)3+NH3↑+OH-
(2)B,引入的Ca2+对人体无害,易被除去,并且价格便宜。
(3)c中还原剂来源广泛,氧化产物为水,既不污染环境又不会引入对人体有害的铝离子。
24、(12分,每空2分)(1)HgC142- ; HgC12
(2)Hg2++2H2O Hg(OH)2+2H+ ;在硝酸中配制
(3)①Cu+Hg2+
Cu2++Hg ;②1.6×10-47mol/L
25、(9分)(1)C和E(2分)
(2)  (2分)
(2分)
氧化反应(1分)
(4)C(1分)
|