
题目列表(包括答案和解析)
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)根据图1提供的信息,写出该反应的热化学方程式 ,在图1中曲线 (填“a” 或“b”)表示加入铁触媒的能量变化曲线。
图1 图2
 [
[
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是
A.3v(H2)正=2v(NH3)逆 B.单位时间内生成nmol N2的同时生成2nmolNH3
C.混合气体的密度不再改变 D.容器内压强不随时间的变化而变化
(3)一定温度下,向2L密闭容器中充入1molN2和3molH2,保持体积不变,0.5min后达到平衡,测得容器中有0.4mol NH3,则平均反应速率v(N2)= ,该温度下的平衡常数K= 。若升高温度,K值变化 (填“增大”、“减小”或“不变”)。
(4)为了寻找合成NH3的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 | T(℃) | n (N2)/n(H2) | P(MPa) |
| ⅰ | 450 | 1/3 | 1 |
| ⅱ | _ | _ | 10 |
| ⅲ | 480 | _ | 10 |
A.请在上表空格中填入剩余的实验条件数据。
 B.根据反应N2+ 3H2
B.根据反应N2+ 3H2![]() 2NH3的特点,在给出的坐标图2中,
2NH3的特点,在给出的坐标图2中,
画出其在1MPa和10MPa条件下H2的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
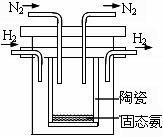
(5)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的 SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解合成氨。其实验装置如图。阴极的电极反应式 。

| ||
| ||
| ||
| ||

| ||
| ||
(1)化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中一种异构体易溶于水,则此种化合物是________(填“极性”、“非极性”)分子.
(2)今有A、B、C、D四种元素,它们的原子序数依次增大,且均小于18,A和B在同一周期,A原子p能级有一个空轨道,B原子的p能级有两个未成对电子,0.1 mol C单质能从酸中置换出2.24 L氢气(标准状态),此时它就变成与B离子电子层排布完全相同的离子.D离子的半径在B、C、D中为最小.则:
①A是________,B是________,C是________,D是________.(填名称)
②A单质和B单质充分反应生成的化合物的电子式是________.
③我国科学工作者于20世纪90年代在兰州制备出过去一直依赖进口,价格十分昂贵的B的一种同位素形成的单质,1 mol这种单质中含中子的物质的量是20 mol,则这种同位素原子的符号为________.
(3)NH3·H2O的电离方程式为NH3·H2O![]() NH4++OH-,试判断溶于水后,形成的合理结构是________.(填下图中的字母)
NH4++OH-,试判断溶于水后,形成的合理结构是________.(填下图中的字母)

(4)把CoCl2溶于水后加氨水直到先生成的Co(OH)2沉淀又溶解后,再加氨水,使生成[Co(NH3)6]2+,此时向溶液中通入空气,得到的产物中有一种其组成可用CoCl3·5NH3表示,Co的配位数是6.把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀.经测定,每1 mol CoCl3·5NH3只生成2 mol AgCl.CoCl3·5NH3中Co化合价为________,请写出表示此配合物结构的化学式:________.
(5)核内中子数为N的R2+,质量数为A,则ng它的氧化物中所含质子的物质的量是________.
(6)Mg晶体的熔点比Na晶体________(填“高”或“低”),原因是________.
从原子、分子水平上帮助我们认识物质构成的规律;以微粒之间不同的作用力为线索,研究不同类型物质的有关性质;从物质结构决定性质的视角预测物质的有关性质.

(1)下列说法正确的是 (填字母).
A.元素电负性由大到小的顺序为F>O>N
B.一个苯分子含3个π键和6个σ键
C.氯化钠和氯化铯晶体中氯离子的配位数相同
D.第一电离能的大小为Br>Se>As
(2)根据等电子体原理,羰基硫(OCS)分子的结构式为 .光气(COCl2)各原子最外层都满足8电子稳定结构,COCl2分子空间构型为 (用文字描述).
(3)Cu 2+基态的电子排布式为 .向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4晶体,该物质中配位原子的杂化方式为 ,不考虑空间构型,其内界结构可用示意图表示为 .
一、选择题(每题3分,共54分)
1.A 2.C 3.D 4.A 5.D 6.B 7.B 8.A 9.A 10.B
11.A 12.D 13.D 14.A 15.C 16.A 17.C 18.D
二、填空题(每空1分,方程式及配平每个2分,共17分)
19. 极; ;三角锥;NH3?H2O ;NH4+
;三角锥;NH3?H2O ;NH4+
20. 浓硫酸 浓硝酸
21. 硝酸分解生成的NO2溶于硝酸;4HNO3  4NO2↑+O2↑+
2H2O;不稳定,易分解
4NO2↑+O2↑+
2H2O;不稳定,易分解
22. (1)8 6 7 12 (2) 3 8 2 3 2 4 (3)3 2 4 2 3
三、推断题(每空1分,方程式2分,共9分)
23.(1)氢 氮 氧 (2)N2O5 (3)NH4+ OH-
(4)NH4NO3
2NH4NO3 2N2↑+O2↑+4H2O↑
2N2↑+O2↑+4H2O↑
三、实验题(每空2分,共10分)
24.(1)B→G→D(或A→G→D)
(2)

 (或NH3?H2O
(或NH3?H2O NH3↑+H2O)
NH3↑+H2O)
(3)避免空气对流影响NH3纯度
(4)干燥管
(5)将湿润的红色石蕊试纸置于管口附近,若试纸变蓝表明已集满,否则未集满
四、计算题(共10分)
25.
高二化学参考答案:
一、选择题(每题3分,共54分)
1.A 2.C 3.D 4.A 5.D 6.B 7.B 8.A 9.A 10.B
11.A 12.D 13.D 14.A 15.C 16.A 17.C 18.D
二、填空题(每空1分,方程式及配平每个2分,共17分)
19. 极; ;三角锥;NH3?H2O ;NH4+
;三角锥;NH3?H2O ;NH4+
20. 浓硫酸 浓硝酸
21. 硝酸分解生成的NO2溶于硝酸;4HNO3  4NO2↑+O2↑+
2H2O;不稳定,易分解
4NO2↑+O2↑+
2H2O;不稳定,易分解
22. (1)8 6 7 12 (2) 3 8 2 3 2 4 (3)3 2 4 2 3
三、推断题(每空1分,方程式2分,共9分)
23.(1)氢 氮 氧 (2)N2O5 (3)NH4+ OH-
(4)NH4NO3
2NH4NO3 2N2↑+O2↑+4H2O↑
2N2↑+O2↑+4H2O↑
三、实验题(每空2分,共10分)
24.(1)B→G→D(或A→G→D)
(2)

 (或NH3?H2O
(或NH3?H2O NH3↑+H2O)
NH3↑+H2O)
(3)避免空气对流影响NH3纯度
(4)干燥管
(5)将湿润的红色石蕊试纸置于管口附近,若试纸变蓝表明已集满,否则未集满
四、计算题(共10分)
25.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com