合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为N
2(g)+3H
2(g)?2NH
3(g)△H=-92.2kJ?mol
-1.合成氨工业中原料气N
2可从空气中分离得到,H
2可用甲烷或焦炭与水蒸气反应制得.
(1)在一容积固定的密闭容器中注入N
2和H
2两种气体,发生上述反应.在某温度下达到平衡时,各物质的浓度分别是:c(H
2)=9.00mol?L
-1,c(N
2)=3.00mol?L
-1,c(NH
3)=4.00mol?L
-1,此温度下该反应的平衡常数K=
0.0073
0.0073
.
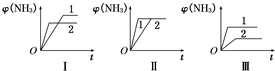
(2)在三个相同容器中各充入1mol N
2和3mol H
2,在不同条件下反应并达到平衡,氨的体积分数随时间变化的曲线如图所示.下列说法中正确的是
D
D
(填字母).
A.图Ⅰ可能是不同压强对反应的影响,且p
2>p
1B.图Ⅱ可能是不同压强对反应的影响,且p
1>p
2C.图Ⅲ可能是不同温度对反应的影响,且T
1>T
2D.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2
(3)将水蒸气通过红热的炭即可产生水煤气,化学方程式为:
C(s)+H
2O(g)═H
2(g)+CO(g)△H=+131.3kJ?mol
-1,△S=+133.7J?K
-1?mol
-1该反应在常温下能否自发进行?
不能
不能
(填“能”或“不能”).

 合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得.
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得.
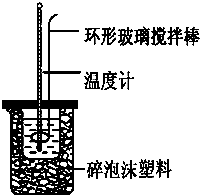 实验室用50mL 0.50mol?L-1盐酸、50mL 0.55mol?L-1 NaOH,利用如图装置进行中和热的测定,请回答下列问题:
实验室用50mL 0.50mol?L-1盐酸、50mL 0.55mol?L-1 NaOH,利用如图装置进行中和热的测定,请回答下列问题: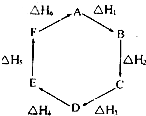 盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关.物质A在一定条件下可发生一系列转化,如图判断下列关系正确的是( )
盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关.物质A在一定条件下可发生一系列转化,如图判断下列关系正确的是( )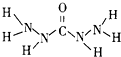 化合物A是近年来采用的锅炉水添加剂,其结构简式如图,A能除去锅炉水中溶解的氧气,下列说法正确的是( )
化合物A是近年来采用的锅炉水添加剂,其结构简式如图,A能除去锅炉水中溶解的氧气,下列说法正确的是( )