
题目列表(包括答案和解析)
|
将50 mL 0.5 mol·L-1的Al2(SO4)3溶液加入4.0 mol·L-1的NaOH溶液可得到1.56 g沉淀,则消耗NaOH的体积是
| |
A. |
45 mL |
B. |
30 mL |
C. |
15 mL |
D. |
60 mL |

图4-10
A.45 mL B.30 mL C.15 mL D.60 mL
| 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | 35℃以上分解 | |||
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
| A、第一、二步反应的基本类型为化合反应、分解反应 |
| B、第一、二步反应之间的主要实验操作是过滤、洗涤 |
| C、第一步反应控制温度高于30℃目的是提高反应产率 |
| D、反应液加盐酸处理可使NaCl循环使用并回收NH4Cl |
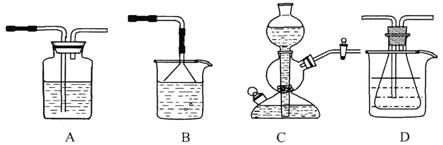
(10分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4C1等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟 “侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸;C:盐酸、碳酸钙;D:含氨的饱和食盐水、水
四种盐在不同温度下的溶解度(g/100g水)表
|
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36_3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | —① | — | — | — |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 |
|
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
(说明:①>35℃NH4HCO3会有分解)
请回答以下问题:
(1)装置的连接顺序应是 (填字母)。
(2)A装置中盛放的试剂是 ,其作用是 。
(3)在实验过程中,需要控制D温度在30℃~35℃,原因是 。
(4)反应结束后,将锥形瓶浸在冷水中,析出NaHCO3晶体。用蒸馏水洗涤NaHCO3晶体的目的是除去 杂质(以化学式表示)
(5)将锥形瓶中的产物过滤后,所得的母液中含有 (以化学式表示),加入氯化氢,并进行 操作,使NaCl溶液循环使用,同时可回收NH4C1。
(10分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4C1等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟 “侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸;C:盐酸、碳酸钙;D:含氨的饱和食盐水、水
四种盐在不同温度下的溶解度(g/100g水)表
|
|
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
|
NaCl |
35.7 |
35.8 |
36.0 |
36_3 |
36.6 |
37.0 |
37.3 |
39.8 |
|
NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
—① |
— |
— |
— |
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
|
|
NH4Cl |
29.4 |
33.3 |
37.2[来源:Z|xx|k.Com] |
41.4 |
45.8[来源:Z*xx*k.Com] |
50.4 |
55.3 |
77.3 |
(说明:①>35℃NH4HCO3会有分解)
请回答以下问题:
(1)装置的连接顺序应是 (填字母)。
(2)A装置中盛放的试剂是 ,其作用是 。
(3)在实验过程中,需要控制D温度在30℃~35℃,原因是 。
(4)反应结束后,将锥形瓶浸在冷水中,析出NaHCO3晶体。用蒸馏水洗涤NaHCO3晶体的目的是除去 杂质(以化学式表示)
(5)将锥形瓶中的产物过滤后,所得的母液中含有 (以化学式表示),加入氯化氢,并进行 操作,使NaCl溶液循环使用,同时可回收NH4C1。
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
C
A
A
C
C
A
B
D
C
C
C
C
C
题号
14
15
16
17
18
19
20
21
22
23
24
25
/
答案
C
B
C
B
C
C
A
C
D
D
A
D
/
二、填空题
26.(每空2分)(1) 2ClO3-+SO2=2ClO2+SO42- (2)B
(3) 0.8×NA (4) 1:8 。
27.(每空1分)(1) O2,KMnO4中 Mn化合降低,则H2O2必作还原剂
2KMnO4+2KF+3H2O2+10HF=2K2MnF6+3O2+8H2O
(2) SbCl5+5HF=SbF5+5HCl
(3) K2MnF6 ,负一价的F
28.(每空1分)(1) H(或氢) 分子晶体
(2) 
(3) N2与任意物质反应均可(N2+3H2=2NH3,N2+3Mg=Mg3N2,N2+O2=2NO等)
 (4) 离子键(离子键和共价键,离子键、共价键和配位键)
(4) 离子键(离子键和共价键,离子键、共价键和配位键)
H++HSO3-=H2O+SO2
29.(每空2分)(1)H2O
(2)Cl2+2OH-=Cl-+ClO-+H2O
(3)4AlCl3+6Na2O2+6H2O=4Al(OH)3↓+12NaCl+3O2↑
(4)阴极 在阴极由于H+得到电子产生H2,破坏了水的电离平衡,促进水继续电离,
导致溶液中c(OH-)>c(H+),溶液呈碱性,所以阴极附近溶液变为红色
|