高中化学学习阶段,氨的催化氧化反应也可用某金属M(相对原子质量<100)的氧化物做催化剂.M元素的离子在一定条件下能与NH
3、卤离子等按某固定比例牢牢结合成稳定的配合物离子(类似于原子团).
(1)150℃、常压下,6.08g该氧化物与0.6mol HCl气体充分发生复分解反应后,氧化物无剩余,气体变为0.48mol.该金属M的相对原子质量为
.
将上述反应所得固体溶于水配成50.0mL溶液,该溶液中溶质的物质的量浓度为
mol?L
-1.
(2)取(1)中所配溶液12.5mL,稀释至25mL,缓缓通入2688mL氨气(标况下),在一定条件下反应恰好完全,得到产物B(摩尔质量为260.5g/mol),继续用1.5mol/L的AgNO
3溶液滴定,达到终点时,耗去AgNO
3溶液40.0mL.将B投入过量烧碱溶液中,未检测出NH
3的逸出.则B的化学式可表示为
.
(3)已知在图中,L的位置完全相同.现有另一种配离子[M(NH
3)
6-xCl
x]
n±(1≤x≤5,且x为整数),结构类似图.
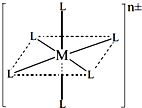
如果该配离子共有2种不同结构,该配离子的式量为
.
(4)一定条件下,3.04g该金属氧化物恰好被某氧化剂(效果相当于0.03mol O
2)氧化,再加入0.05mol KCl,经一些特殊工艺处理,K、M两元素恰好完全形成含氧酸盐(式量<360),且盐内部阴阳离子个数比为1:2.则该盐的式量以及物质的量分别为
.


 记录液面刻度的读数;
记录液面刻度的读数; 根据滴定管的两次读数得出NaOH溶液的体积为22mL
根据滴定管的两次读数得出NaOH溶液的体积为22mL