
题目列表(包括答案和解析)
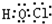
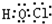
(1)D在元素周期表中的位置是____________。
(2)E离子的结构示意图为____________。
(3)C2的电子式为____________,在E2D2中含有的化学键类型有____________。
(4)由A、B、C、D四种元素组成的离子化合物的化学式为(写出一种即可)____________。
(1)其原子半径大小关系是:D>E>B>C>A;
(2)A、D同主族并可形成离子晶体DA;
(3)B、D、E三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;
(4)B、E两种元素原子的最外层电子数之和等于A、C、D三种元素原子的最外层电子数之和。 请填写下列空白:
①B、E两者的最高价氧化物对应的水化物反应后所得产物的溶液的pH________7(填“>”“<”或“=”);
②D
③1 mol E单质与足量的D的最高价氧化物的水化物溶液反应,能产生______mol A2气体,并写出其反应的离子方程式________________;
④BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为_______________。
(1)其原子半径大小关系是:D>E>B>C>A。
(2)A、D同主族,并可形成离子晶体DA、
(3)B、D、E三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素。
(4)B、E两种元素原子的最外层电子数之和等于A、C、D三种元素原子的最外层电子数之和。
请填写下列空白:
(1)DA与水反应后所得溶液的pH_________(填“>”“<”或“=”)7。
(2)D
(3)1 mol E单质与足量的D的最高价氧化物的水化物溶液反应,能产生_________mol A2气体,并写出其反应的离子方程式__________________。
(4)写出B、D、E三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水的离子方程式:
_____________________________________________________。
_____________________________________________________。
_____________________________________________________。
_____________________________________________________。
(5)化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为___________________________。
A、B、C、D、E五种短周期元素的原子序数依次增大,且知:
(1)其原子半径大小关系是:D>E>B>C>A。
(2)A、D同主族,并可形成离子晶体DA、
(3)B、D、E三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素。
(4)B、E两种元素原子的最外层电子数之和等于A、C、D三种元素原子的最外层电子数之和。
请填写下列空白:
(1)DA与水反应后所得溶液的pH_________(填“>”“<”或“=”)7。
(2)D2C2的电子式__________________。
(3)1 mol E单质与足量的D的最高价氧化物的水化物溶液反应,能产生_________mol A2气体,并写出其反应的离子方程式__________________。
(4)写出B、D、E三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水的离子方程式:
_____________________________________________________。
_____________________________________________________。
_____________________________________________________。
_____________________________________________________。
(5)化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为___________________________。
1
2
3
4
5
6
7
8
D
B
C
A
C
D
D
C
9
10
11
12
13
14
╆╆╆╆╆
╆╆╆╆╆
CD
D
D
CD
B
AD
~~~~~
~~~~~
15.每空均2分,共10分
(1)吸附水中有色物质(脱色);(2)S2-+H2O2=S+2OH―(或:S2-+H2O2+2H+=S↓+2H2O);(3)将水样可能含有的高铁离子及铬酸盐还原;(4)偏低
(5)V1×2c×35.5×1000/V=71000CV1/V
16.(8分)
(1)第三周期第VIIA族 (2分)
(2) 2SO2(g)+O2(g) 2SO3(g)
△H=-196.6 kJ?mol-1 (2分)
2SO3(g)
△H=-196.6 kJ?mol-1 (2分)
(3)Al3++3AlO2-+6H2O=4Al(OH)3↓ (2分) (4) H2O (2分)
 |
17.(10分)
(1) (2分)
(2)2FeCl2+Cl2===2FeCl3 (2分)
(3)2Al+2OH-+2H2O=2AlO2-+3H2↑(2分)
(4)阳极:6O2--12e-=3O2↑;阴极:4Al3++12e-=4Al (每空1分)
(5)错误!未找到引用源。 (2分)
18.⑴S2- + H2O HS- +OH- HS- + H2O
HS- +OH- HS- + H2O H2S +OH-(可不写)
H2S +OH-(可不写)
⑵2.7×10-3 ⑶172.5 ⑷使BaSO4得到充分的还原(或提高BaS的产量)
①②为吸热反应,炭和氧气反应放热维持反应所需高温
19.(12分)
(1)D(2分)
(2)Cu(1分)
(3)H2(1分);①随着反应进行生成铝离子浓度增大,水解程度增大,产生H+的浓度增大,②该反应放热,升高温度反应加快,③铜与铝构成原电池,加快铝溶解。(3分)
(4)A、B、D (3分)
(5)A(1分),电解质性质(合理解答同样给分)(1分)
20.(共10分)
(1)解: 2SO2(g) + O2(g)  2SO3(g)
2SO3(g)
起始浓度/ mol?L-1 0.050 0.030 0
平衡浓度/ mol?L-1 (0.050-0.040) (0.030-0.040/2) 0.040
= 0.010 = 0.010
所以,K = =
=  = 1.6×103 mol?L-1。(不带单位计算也得分)
= 1.6×103 mol?L-1。(不带单位计算也得分)
(SO2)
= ×100%
= 80% 。
×100%
= 80% 。
(2)B、C。 (3)SO2+H2O+Na2SO3=2NaHSO3。
(4)抑制Fe2+、Fe3+的水解,防止Fe2+被氧化成Fe3+。
21.(12分)
解:(1)6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O (2分)
(2)n(Fe)=×2=0.035 mol n(SO42-)==0.045 mol
n(OH-)=3×n(Fe3+)-2×n(SO42-)=3×0.035 mol-2×0.045 mol=0.015 mol (3分)
盐基度=×100%= ×100%=14.29% (2分)
(3)n(H2O)=
=0.054 mol
化学式: Fe35(OH)15(SO4)45?54H2O (3分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com