
题目列表(包括答案和解析)
 9H2O)释放的甲烷气体完全燃烧生成CO2和液态水,放出的热量为___________ kJ。
9H2O)释放的甲烷气体完全燃烧生成CO2和液态水,放出的热量为___________ kJ。 CO2(g) + H2(g),其化学平衡常数K和温度T的关系如下表
CO2(g) + H2(g),其化学平衡常数K和温度T的关系如下表 
(14分)化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的可燃冰是高压下形成的外观像冰的甲烷水合物固体,被称之为“未来能源”。在25 ℃、101 kPa下,1 g甲烷完全燃烧生成CO2和液态水时放热55.6 kJ。甲烷燃烧的热化学方程式为_______________________________________________________;相同条件下,356 g可燃冰(分子式为CH4?9H2O)释放的甲烷气体完全燃烧生成CO2和液态水,放出的热量为 kJ。
(2)二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效的优良性能。
① 写出一种与二甲醚相对分子质量相等且元素种类相同的有机物的结构简式________。
② 二甲醚可由合成气(CO和H2)在一定条件下制得。用合成气制二甲醚时,还产生了一种可参与大气循环的无机化合物,该反应的化学方程式可能是:![]()
________________________________________________________________。
③ 以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是:______________________________________________。
④ 在容积固定的密闭容器中进行化学反应:CO(g) + H2O(g)  CO2(g) + H2(g),其化学平衡常数K和温度T的关系如下表:
CO2(g) + H2(g),其化学平衡常数K和温度T的关系如下表:
T /℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
该反应的化学平衡常数表达式为K=____________________________。该反应的正反应是__________反应(填“吸热”或“放热”)。
硫酸用途十分广泛,工业上合成硫酸时,将SO2转化为催化氧化是一个关键步骤。请回答下列问题:
(1)该反应在恒温恒容密闭容器中进行,判断其达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)某温度下,2SO2(g)+O2(g) 2SO3(g) △H=-196 kJ?mol-1。在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3为0.18 mol,则v(O2)= mol?L-1?min-1,放出的热量为 kJ。
2SO3(g) △H=-196 kJ?mol-1。在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3为0.18 mol,则v(O2)= mol?L-1?min-1,放出的热量为 kJ。
(3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示。试分析工业生产中采用常压的原因是 。
(4)将一定量的SO2和0.7 molO2放入一定体积的密闭容器中,在550℃和催化剂作用下发生反应。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。则该反应达到平衡时SO2的转化率是多少?(要写出计算过程,计算结果保留一位小数。)
 2SO3(g) △H=-196 kJ?mol-1。在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3为0.18 mol,则v(O2)= mol?L-1?min-1,放出的热量为 kJ。
2SO3(g) △H=-196 kJ?mol-1。在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3为0.18 mol,则v(O2)= mol?L-1?min-1,放出的热量为 kJ。 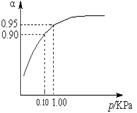
一、二(63分)
题序
1
2
3
4
5
6
7
8
9
答案
D
B
B
C
B
D
A
C
D
题序
10
11
12
13
14
15
16
17
18
答案
C
D
AD
B
CD
B
A
AC
BD
三、(本题包括2小题,共27分)
19、(11分)(1)搅拌、加热(2分)(2)坩埚钳(1分),用玻璃棒不断搅拌滤液(1分)(3)NaCl(2分)
 (4)稀释溶液,防止降温过程中NaCl析出,提高产品纯度(3分)(5)重结晶(2分)。
(4)稀释溶液,防止降温过程中NaCl析出,提高产品纯度(3分)(5)重结晶(2分)。
20(16分)(1)引流作用(1分) (2) 2H2O2 == 2H2O + O2↑(3分) (3) 炭(或碳、或C) (2分)
(4)(一)[判断猜想]:猜想I不成立 (1分)
(二)[验证(操作)过程]:取少量滤液逐滴滴入稀氨水 (3分)
[实验现象]:先有白色沉淀、滴入过量稀氨水后白色沉淀溶解(3分);
[判断猜想]:结论:主要为氯化锌,其中含少量的氯化铵(3分)。
[若说成氯化铵和氯化锌的混合物给1分;若说成只有氯化锌没有氯化铵0分]
四、(本题包括3小题,共40分)
(3)B、C; (3分,若只选一个对的得1分,全对得3分)
(4)设3min―4min达到平衡时CO、H2 O的平衡浓度为c3, 则CO2 、H2的平衡浓度分别为0.200-c3和0.300- c3
根据: K= (2分)
(2分)
c3=0.120 mol/L (2分,写0.12的不给分) ;
22(12分)(1)Fe(OH)3(2分) (2)氨水 (2分) 不会引入新的杂质(1分)
(3)2Fe3++3Mg(OH)2 == 3 Mg2+ +2Fe(OH)3 (3分)
(4)A C D E (4分)(选对1个给1分,选错1个倒扣1分,但不出现负分。)
23(15分)(1)113~
(5)H2S(g) = H2(g) + S(s) △H = +112.2KJ/mol (3分) (6) 硒 (2分) 氧气 (2分)
五、(本题包括1小题,共10分)
24.(10分)(1)小(1分)(2)CH2=CH2 + H2O → CH3CH2OH (1分)100%(1分)
(3)D E(共2分)(4)①3(2分)
③BCD(2分,漏1个扣1分,漏2个和错选均为0分)
六、(本题包括2小题,每小题10分。考生只能选做一题。26题为“有机化学基础”内容试题,27小题为“物质结构”内容试题)
25 (10分)(1)[根据答到的要点或关键词给分]
①在此条件下,卤代烃的消去反应和取代反应同时进行(1分),有利于消去反应(1分)。
②在此条件下,有利于生成对称烯烃(1分),且卤原子半径越大(1分)越有利于生成对称烯烃(1分)。
若回答只是数据翻译,如:消去(取代)产物比例较大(小),或消去反应谁的比例大、谁的比例小,说出一点给1分,说出几点都如此最多给2分。
 |
⑵① (1分) CH3C≡CH (1分)
 |
|||
 |
|||
26.(10分)
(1) 3d84s2 (2分) ,分子晶体(1分), CO(1分)。
(2) B C (2分) (3)20 (2分) (4)Cu2++4H2O=[Cu(H2O)4]2+ (2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com