
题目列表(包括答案和解析)
| Ksp | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 2.6×10-39 | 1.9 | 3.2 |
| Cu2+ | 2.2×10-20 | 4.7 | 6.7 |
| ||
| ||
| 1 |
| 2 |
【化学——选修3:物质结构与性质】(15分)
用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下:
(1)已知在反应①、②中均生成相同的气体分子,该气体具有漂白性。请分别写出反应①、
②的化学方程式是 、 。
(2)基态铜原子的核外电子排布式为 ,硫、氧元素相比,第一电离能较大的是 。
(3)反应①和②生成的气体分子的中心原子的杂化类型是 ,分子的空间构型是 。
(4)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因 ;在该晶体中存在化学键的种类有 。
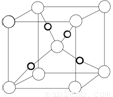
(5)Cu2O的晶胞结构如图所示,该晶胞的边长为a cm,则Cu2O的密
度为 g·cm-3(用NA表示阿伏加德罗常数的数值)。
【化学——选修3:物质结构与性质】(15分)
用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下:
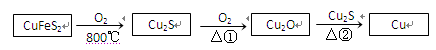
(1)已知在反应①、②中均生成相同的气体分子,该气体具有漂白性。请分别写出反应①、
②的化学方程式是 、 。
(2)基态铜原子的核外电子排布式为 ,硫、氧元素相比,第一电离能较大的是 。
(3)反应①和②生成的气体分子的中心原子的杂化类型是 ,分子的空间构型是 。
(4)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因 ;在该晶体中存在化学键的种类有 。
(5)Cu2O的晶胞结构如图所示,该晶胞的边长为a cm,则Cu2O的密
度为 g·cm-3(用NA表示阿伏加德罗常数的数值)。
有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)氧化成硫酸盐。运用该原理生产铜和绿矾(FeSO4·7H2O)的流程如下:
回答下列问题:
(1)已知:
|
|
Fe2+ |
Cu2+ |
Fe3+ |
|
开始转化成氢氧化物沉淀时的pH |
7.6 |
4.7 |
2.7 |
|
完全转化成氢氧化物沉淀时的pH |
9.6 |
6.7 |
3.7 |
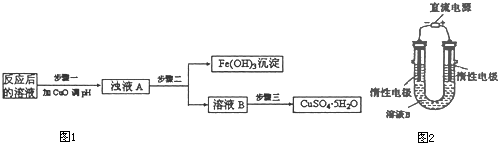
(1)加入CuO将溶液的pH调节到约为4,结合平衡移动原理解释该操作的原因 。
(2)写出能实现反应Ⅲ的化学方程式 。
(3)试剂b为 。
(4)欲从滤液中获得绿矾晶体,操作Ⅰ应为浓缩、 、 。
(5)反应Ⅰ的化学方程式 。



湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com