
题目列表(包括答案和解析)

表1 物质沉淀时的pH
物 质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀时的pH | 2.7 | 7.6 | 5.2 |
完全沉淀的pH | 3.7 | 9.6 | 6.4 |
表2 备选试剂
序 号 | A | B | C | D | E |
化学式 | NaOH | CuO | H2O2 | 稀HNO3 | KMnO4 |
回答下列问题:
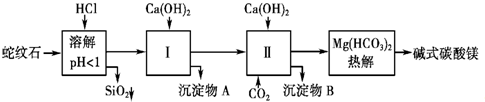
(1)X_________;Y_________。(填写备选试剂中的序号)
(2)沉淀(Ⅱ)的化学式_____,证明步骤③中沉淀是否完全的操作方法是____________。
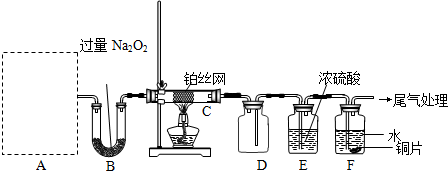
(3)第⑤步骤操作中,所需装置如图所示:

按气流从左至右的方向,各装置接口的连接顺序为_________。
D装置的作用是______________________;理由______________________。
(每空2分 共14分)现有NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl—、SO42-、NO3—的相互分离,实验过程如图所示: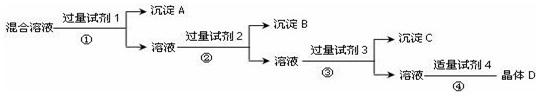
请回答下列问题:
(1)写出实验过程中所用试剂为:
试剂1__________试剂2___________试剂3__________试剂4____________
(2)加入试剂3过量的目的是____________________________________________
(3)操作①的名称是_____________
(4)在加入试剂4后,获得晶体D的实验操作④的名称是_____________



| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| pH | 3.4 | 5.2 | 12.4 |

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com