
题目列表(包括答案和解析)
在0.1 mol?L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+
CH3COO-+H+
对于该平衡,下列叙述正确的是
A.加入水时,平衡向正反应方向移动,pH减小
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol?L-1 HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
将0.1 mol?L-1CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起
A.溶液的pH增加 B.CH3COOH电离度变大
C.溶液的导电能力减弱 D.溶液中[OH-]减小
将0.1 mol?L-1CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起( )
A.溶液的pH增加 B.CH3COOH电离度变大
C.溶液的导电能力减弱 D.溶液中c(OH-)减小
下列溶液中有关物质的量浓度关系正确的是
A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH) < c(CH3COONa) < c(Na2CO3)
B.已知0.1 mol?L-1 二元酸H2A溶液的pH=4,则在0.1 mol?L-1 Na2A溶液中:
c(OH-) = c(HA-) + c(H+) + 2c(H2A)
C.将0.1 mol?L-1醋酸溶液加水稀释,则溶液中的c(H+)和c(OH-)都减小
D.向0.1 mol?L-1的氨水中加入少量硫酸铵固体,则溶液中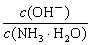 增大
增大
下列溶液中微粒的物质的量浓度关系正确的是
A.室温下,向0.01 mol?L-1NH4HSO4溶液中滴加NaOH溶液至中性:
c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
B.0.1 mol?L-1NaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+)
C.Na2CO3溶液:c(OH-)=c(HCO3-)+c(H2CO3)+c(H+)
D.25℃时,pH=4.75、浓度均为0.1 mol?L-1的CH3COOH、CH3COONa混合溶液:
c(CH3COO-)+c(OH-)<c(CH3COOH)+C(H+)
1
2
3
4
5
6
7
8
9
C
C
B
D
B
D
B
C
D
10
11
12
13
14
15
16
17
18
D
C
D
B
B
D
B
B
A
19
20
21
22
23
24
25
――
――
A
B
D
B
C
C
A
26、(14分)
⑴电解池 ,原电池 (2分,各1分)
2H2O+2CuSO4 = 2Cu+O2↑+2H2SO4 (5分,第一空1分,其它各2分)
(3)0.02 ,增加 ,0.63 , 1 。(7分,第二空1分,其它各2分)
27、(10分)
(1)Fe3++3H2O Fe(OH)3+3H+ ,将FeCl3先溶于盐酸,然后再加水稀释 。
Fe(OH)3+3H+ ,将FeCl3先溶于盐酸,然后再加水稀释 。
碳酸钙消耗了H+,使Fe3+水解程度增大,形成Fe(OH)3沉淀。(6分,各2分)
(2)白色悬浊液逐渐转变为黑色悬浊液。2AgCl(s)+S2―=Ag2S(s)+2Cl―。(4分,各2分)
28.(9分)
(1)增大 (2分)(2) 15―20min、25―30min 。(2分)
(3) 增大氧气的浓度,a、b。(3分,第二空2分,多选不给分)
(4)不 、向左。(2分,各1分)
29.(11分)
(1)①转移,定容 ②烧杯(或表面皿)、药匙。(4分,各1分)
(2)①溶液从无色恰好变为红色,且半分钟内不褪去。
②0.11mol?L-1 ③ 丙 ④ D (7分,第三空1分,其它各2分)
30.(6分)(1)0.04 mol?L-1?min-1、80% (2)16%
(算出反应速率且过程正确的给4分,转化率和体积分数各给1分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com