
题目列表(包括答案和解析)
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
(1) 配制100mL 0.10mol/L NaOH标准溶液。
(2) 取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的现象是 。此时锥形瓶内溶液的pH为 。
②根据上述数据,可计算出该盐酸的浓度约为 (保留两位有效数字)
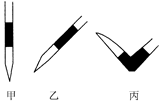
③排去碱式滴定管中气泡的方法应采用操作 ,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

![]()
![]()
甲 乙 丙
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。(多选扣分)
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量前NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
(1) 配制100mL 0.10mol/L NaOH标准溶液。
(2) 取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的现象是 。此时锥形瓶内溶液的pH为 。
②根据上述数据,可计算出该盐酸的浓度约为 (保留两位有效数字)
③排去碱式滴定管中气泡的方法应采用操作 ,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

![]()
![]()
甲 乙 丙
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。(多选扣分)
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量前NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
(1) 配制100mL 0.10mol/L NaOH标准溶液。
(2) 取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 23.96 | 20.00 |
| 2 | 0.10 | 24.00 | 20.00 |
| 3 | 0.10 | 24.04 | 20.00 |
①滴定达到终点的现象是 ,
③排去碱式滴定管中气泡的方法应采用操作 ,然后轻轻挤压玻璃球使尖嘴部分 充满碱液;
甲 乙 丙
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
A、滴定终点读数时仰视读数 B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥 D、滴定中振荡锥形瓶是,不小心有液体溅出
E、碱式滴定管尖嘴部分有气泡,滴定后消失
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含____________(填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含______________所致。
(3)设计实验并验证:
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| 选用试剂 | 实验现象 |
方案1 |
|
|
方案2 |
|
|
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1—2滴溴水,溶液呈黄色所发生的离子反应方程式为____________________________________________。
②在100 mL FeBr2溶液中通入2.24 LCl2(标准状况),溶液中有1/3的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为____________。
Ⅱ.某校化学实验兴趣小组为“证明某水煤气中CO2、CO、H2、H2O(气)共同存在”。经讨论从以下提供的仪器和药品中设计组合成一套装置(假设其他杂质气体对本实验无干扰)
(1)该小组证明CO2存在应选用____________装置,现象是:_______________________。证明H2O(气)的存在应选用_____________装置,现象是______________________________。
(2)若某些仪器可重复使用,某些仪器可不使用,B中反应完全进行,连接的玻璃导管、胶管忽略。按气流从左到右,用上述字母把各装置连接组合起来,正确的连接次序是:混合气体—( )—( )—( B)—( )—( )—( )。
(3)此实验的操作步骤中还有一欠缺之处,应如何改进?
实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验。请完成填空:
(1)配制100 mL 0.10 mol/L NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)转移→洗涤(并将洗涤液移入容量瓶)→ →将配制好的溶液倒入试剂瓶中,贴上标签。
②称量 g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、 、 。
(2)取20.00 mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
| 实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时, NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
1
2
3
4
5
6
7
8
9
C
C
B
D
B
D
B
C
D
10
11
12
13
14
15
16
17
18
D
C
D
B
B
D
B
B
A
19
20
21
22
23
24
25
――
――
A
B
D
B
C
C
A
26、(14分)
⑴电解池 ,原电池 (2分,各1分)
2H2O+2CuSO4 = 2Cu+O2↑+2H2SO4 (5分,第一空1分,其它各2分)
(3)0.02 ,增加 ,0.63 , 1 。(7分,第二空1分,其它各2分)
27、(10分)
(1)Fe3++3H2O Fe(OH)3+3H+ ,将FeCl3先溶于盐酸,然后再加水稀释 。
Fe(OH)3+3H+ ,将FeCl3先溶于盐酸,然后再加水稀释 。
碳酸钙消耗了H+,使Fe3+水解程度增大,形成Fe(OH)3沉淀。(6分,各2分)
(2)白色悬浊液逐渐转变为黑色悬浊液。2AgCl(s)+S2―=Ag2S(s)+2Cl―。(4分,各2分)
28.(9分)
(1)增大 (2分)(2) 15―20min、25―30min 。(2分)
(3) 增大氧气的浓度,a、b。(3分,第二空2分,多选不给分)
(4)不 、向左。(2分,各1分)
29.(11分)
(1)①转移,定容 ②烧杯(或表面皿)、药匙。(4分,各1分)
(2)①溶液从无色恰好变为红色,且半分钟内不褪去。
②0.11mol?L-1 ③ 丙 ④ D (7分,第三空1分,其它各2分)
30.(6分)(1)0.04 mol?L-1?min-1、80% (2)16%
(算出反应速率且过程正确的给4分,转化率和体积分数各给1分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com