
题目列表(包括答案和解析)
| 实验 | 操作步骤 | 现象 |
| 1 | 取少量加碘食盐溶解,滴入几滴稀硫酸,滴入少量KI淀粉溶液,振荡 | 溶液变蓝 |
| 2 | 取少量NaCl溶解,滴入几滴稀硫酸,滴入少量KI淀粉溶液,振荡 | 溶液变蓝 |
| 3 | 取少量水… | 溶液变蓝 |
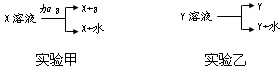
| 实验 | 操作步骤 | 现象 |
| 1 | 取少量加碘食盐溶解,滴入几滴稀硫酸,滴入少量KI淀粉溶液,振荡 | 溶液变蓝 |
| 2 | 取少量NaCl溶解,滴入几滴稀硫酸,滴入少量KI淀粉溶液,振荡 | 溶液变蓝 |
| 3 | 取少量水… | 溶液变蓝 |
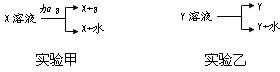
| 实验 | 操作步骤 | 现象 |
| 1 | 取少量加碘食盐溶解,滴入几滴稀硫酸,滴入少量KI淀粉溶液,振荡 | 溶液变蓝 |
| 2 | 取少量NaCl溶解,滴入几滴稀硫酸,滴入少量KI淀粉溶液,振荡 | 溶液变蓝 |
| 3 | 取少量水… | 溶液变蓝 |
| 实验 | 操作步骤 | 现象 |
| 1 | 取少量加碘食盐溶解,滴入几滴稀硫酸,滴入少量KI淀粉溶液,振荡 | 溶液变蓝 |
| 2 | 取少量NaCl溶解,滴入几滴稀硫酸,滴入少量KI淀粉溶液,振荡 | 溶液变蓝 |
| 3 | 取少量水… | 溶液变蓝 |
Na2SO3是抗氧剂.向烧碱和Na2SO3混合溶液中加入少许溴水,振荡后溶液变为无色.
(1)写出碱性中Br2氧化Na2SO3的离子方程式________.
(2)反应后的溶液含有SO![]() 、SO
、SO![]() 、Br-、OH-等阴离子,请填写鉴定其中SO
、Br-、OH-等阴离子,请填写鉴定其中SO![]() 和Br-的实验报告(步骤可增减).
和Br-的实验报告(步骤可增减).
限选试剂:2 mol·L-1 HCl;1 mol·L-1 H2SO4;1 mol·L-1 BaCl2;1 mol·L-1 Ba(NO3)2;0.1 mol·L-1 AgNO3;CCl4;新制饱和氯水.

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com