
题目列表(包括答案和解析)
实验步骤:
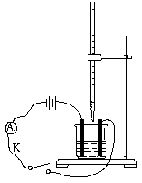
1. 向碱式滴定管和烧杯中分别注入Ba(OH)2溶液和少量硫酸,并向稀硫酸中滴加几滴石蕊试液,按如右图所示装置连接好。
2. 按下开关接通电路,观察电流计指针偏转情况。
现象:_______________________________。
结论:_______________________________。
3. 挤压碱式滴定管胶管里的玻璃珠向烧杯中滴加Ba(OH)2溶液,观察溶液中的现象和电流计指针的变化情况。
现象:_______________________________。
结论:_______________________________。
思考:
1. 稀硫酸与Ba(OH)2溶液反应的实质是什么?
2.该实验说明溶液的导电性与 ____________________________有关。
3. 如果把硫酸溶液改为醋酸溶液,Ba(OH)2溶液改为氨水,仍按照上述操作进行实验,将看到的现象是:___________________。

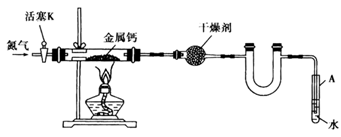
已知:A中装有NaNO2和NH4Cl混合溶液;B中装有碱石灰,C中有铁铈合金,D中有酚酞试液。C中发生反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g);ΔH=-92.4 kJ·mol-1。
2NH3(g);ΔH=-92.4 kJ·mol-1。
实验步骤如下:①检查装置的气密性;②用酒精灯加热NH4Cl和NaNO2饱和溶液,待有气体生成,可停止加热,但仍有大量气体产生;③再用酒精灯给铁铈合金加热至一定温度;④从胶头滴管中滴加一定浓度盐酸,不久见酚酞试液变红。
回答下列问题:
(1)写出A中两溶液间发生反应的化学方程式____________________________________,此反应为________热反应(填“放”或“吸”)。
(2)先用酒精灯加热NH4Cl、NaNO2饱和溶液的目的是__________________。
(3)C中铁铈合金的作用是____________________________,要先加热至一定温度的原因是____________________________。
(4)如果通入C中的N2、H2各有1 mol、3 mol,为什么反应后放出的热量比92.4 kJ少?

a.冰醋酸14.3mL(约0.25mol),b.95%乙醇23mL(约0.37mol),c.浓H2SO4,d.饱和 Na2CO3溶液,e.饱和CaCl2溶液(CaCl2易跟乙醇生成CaCl2·6C2H5OH)。
实验过程主要是将各装置连接好并检查气密性后,进行以下各步骤:
①在蒸馏烧瓶里注入少量乙醇和所需全部浓 H2SO4并混合均匀。在分液漏斗里加入剩下的乙醇和全部冰醋酸并混合均匀。
②用油浴加热,温度保持在130℃~140℃。
③将分液漏斗内液体缓缓滴入蒸馏烧瓶。调节滴入液体速率,使之与馏出酯的滴液速率大致相同,直到加料完毕。
④温度保持一段时间,至没有液体馏出时,停止加热。
⑤取下锥形瓶B,将饱和Na2CO3溶液分批分次加到馏出液里,边加边摇荡至没有气泡产生时为止。
⑥将B中液体在另一分液漏斗中分液,弃去水层。
⑦在分液漏斗油层中加入饱和CaCl2溶液,摇荡后静置,分层分液,弃去水层。油层为粗制乙酸乙酯。
试回答:
(1)配料中的乙醇和乙酸未按物质的量比1∶1配制的理由是________。
(2)浓H2SO4的作用是________。
(3)操作③使加料与馏出液速率大致相等的理由是________。
(4)用饱和Na2CO3溶液洗涤酯的目的是________,用饱和CaCl2溶液洗涤酯的目的是________。
(5)如果同时用Na2CO3与CaCl2两种饱和溶液冼涤酯时,会出现的情况是________。
(6)在粗酯中还杂有的主要有机物是________,产生它的原因是________。
(7)实验时B瓶支管有长导管通向室外的理由是________。
实验室制取乙酸乙酯的装置如图。实验使用的药品如下(烧杯夹持装置、温度计已略去):

a.冰醋酸14.3mL(约0.25mol),b.95%乙醇23mL(约0.37mol),c.浓H2SO4,d.饱和 Na2CO3溶液,e.饱和CaCl2溶液(CaCl2易跟乙醇生成CaCl2·6C2H5OH)。
实验过程主要是将各装置连接好并检查气密性后,进行以下各步骤:
①在蒸馏烧瓶里注入少量乙醇和所需全部浓 H2SO4并混合均匀。在分液漏斗里加入剩下的乙醇和全部冰醋酸并混合均匀。
②用油浴加热,温度保持在130℃~140℃。
③将分液漏斗内液体缓缓滴入蒸馏烧瓶。调节滴入液体速率,使之与馏出酯的滴液速率大致相同,直到加料完毕。
④温度保持一段时间,至没有液体馏出时,停止加热。
⑤取下锥形瓶B,将饱和Na2CO3溶液分批分次加到馏出液里,边加边摇荡至没有气泡产生时为止。
⑥将B中液体在另一分液漏斗中分液,弃去水层。
⑦在分液漏斗油层中加入饱和CaCl2溶液,摇荡后静置,分层分液,弃去水层。油层为粗制乙酸乙酯。
试回答:
(1)配料中的乙醇和乙酸未按物质的量比1∶1配制的理由是________。
(2)浓H2SO4的作用是________。
(3)操作③使加料与馏出液速率大致相等的理由是________。
(4)用饱和Na2CO3溶液洗涤酯的目的是________,用饱和CaCl2溶液洗涤酯的目的是________。
(5)如果同时用Na2CO3与CaCl2两种饱和溶液冼涤酯时,会出现的情况是________。
(6)在粗酯中还杂有的主要有机物是________,产生它的原因是________。
(7)实验时B瓶支管有长导管通向室外的理由是________。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com