
题目列表(包括答案和解析)
| 有机物\物理性质 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 1-萘乙酸 | 134.5 | 285(分解) | 易溶于热水,难溶于冷水,易溶于碱 |
| 萘 | 80.5 | 219.9 | 不溶于热水 |
| 氯乙酸 | 62 | 189 | 溶于水 |
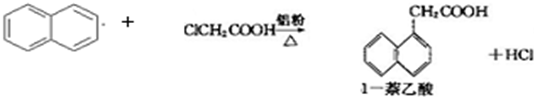
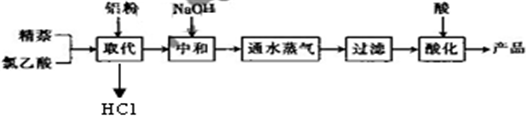
| 实验方法和操作 | 实验目的 |
| 1.把产品放入容器中,加入适量的蒸馏水,加热并充分搅拌; | 溶解1-萘乙酸和氯乙酸、氯化铝等水溶性杂质 溶解1-萘乙酸和氯乙酸、氯化铝等水溶性杂质 |
| 2. 趁热过滤 趁热过滤 |
除去杂质萘; |
| 3. 取滤液 取滤液 ,再过滤,洗涤,干燥. |
得到提纯的产品1-萘乙酸. |
(15分)氯酸钾是无机盐工业的重要产品之一,可通过反应:NaC1O3+KC1
KC1O3↓+NaC1制取。
(1)实验室制取氯酸钠可通过反应:3C12+6NaOH 5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。
5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。

(2)工业上制取氯酸钠采用在热的石灰乳通入氯气,然
后结晶除去氯化钙后,再加入一种钠盐,合适的钠盐是
。
(3)北美、欧洲国家生产氯酸钠用二级精制盐水。采用
无隔膜电解法获得,生产过程中涉及的主要的化学反应式如下:
总反应式:NaC1+3H2O NaC1O3+3H2↑
NaC1O3+3H2↑
阳极:2C1——2e—
C12↑阴极:2H2O+2e—
H2↑+2OH—
液相反应:C12+H2O HC1O+H++C1—
HC1O
HC1O+H++C1—
HC1O H++C1O—
H++C1O—
2HC1O+CO— C1O3—+2C1—+2H+
①
精制食盐水时,要除去其中的Ca2+、Mg2+及SO42—并得到中性溶液,依次加入的化学试剂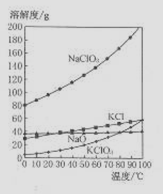
② 是 、 、 ;过滤,滤液中再加入适量的稀盐酸,得一级精制盐水再经离子交换处理或膜处理得到二级精制盐水。
②电解时,必须在食盐水中加入Na2Cr2O2,其目的是防止 (填离子符号)电解过程中在阴极上放电。
(4)若NaC1O2与KC1的混合溶液中NaC1O3与KC1的质量分数分别为0.290和0.203(相关物质的溶解度曲线如右图)。从混合溶液中获得较多KC1O3晶体的实验操作依次
为 (填操作名称)、干燥。
(5)样品中C1O3—的含量可用滴定法进行测定,实验步骤
如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液。
步骤2:从上述容量瓶中取出10.00mL于锥形瓶中,准确加入25mL1000mol/L(NH4)2Fe(SO4)2。溶液(过量),加入75mL硫酸和磷酸配成的混酸,静置10min。
步骤3:再在锥形瓶中加入100mL蒸馏水及某种氧化还原反应指示剂,用0.200mol/LK2Cr2O2标准溶液滴定至终点。
步骤4: 。
步骤5:数据处理与计算。
①步骤2,静置10min的目的是 。
②步骤3中K2Cr2O2标准溶液应盛放在 中(填仪器名称)。
③为了确定样品中C1O2—的质量分数,步骤4的操作内容是 。
某同学欲用已知物质的量浓度的HCl溶液滴定未知浓度的NaOH溶液时,选择酚酞作指示剂。请回答下列问题:
(1)该同学的实验操作过程如下:
A.取一支碱式滴定管,用蒸馏水洗净
B.加入待测的NaOH溶液,记录液面刻度读数
C.用酸式滴定管精确放出一定量标准液,置于未经标准液润洗的洁净的锥形瓶中
D.在锥形瓶中加入2滴酚酞试液
E.滴定时,边滴加边振荡,同时还要注视滴定管内液面的变化
F.当小心滴到溶液由无色变成粉红色时,30s内不变色即停止滴定
G.记录液面刻度读数
H.据滴定管的两次读数得出所用NaOH溶液的体积为22mL
上述实验过程中有错误的是__________(填编号,下同)。
(2)下列操作可能使所测NaOH溶液浓度偏低的有___________。
A.酸式滴定管洗净后,不经标准HCl溶液润洗就直接使用
B.滴定前锥形瓶用蒸馏水洗净后未经干燥
C.酸式滴定管漏液
D.对碱式滴定管读数时,开始时平视,结束时仰视
E.滴定过程中,由于振荡锥形瓶过于激烈,使少量溶液溅出瓶外
(3)另一同学用0.2010mol/L标准盐酸滴定待测烧碱溶液,根据下表数据,计算待测烧碱溶液的浓度为_______。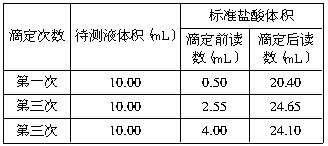
(4)常温时,若用0.1mol/L的NaOH溶液滴定25mL0.1mol/L的盐酸,至终点时不慎少滴加了一滴(每一滴溶液约0.05mL)NaOH溶液,终点时溶液的pH=_____;若不慎多滴加了一滴NaOH溶液,终点时溶液的pH=_______。

(15分)氯酸钾是无机盐工业的重要产品之一,可通过反应:NaC1O3+KC1 KC1O3↓+NaC1制取。
(1)实验室制取氯酸钠可通过反应:3C12+6NaOH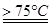 5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。
5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。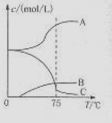
(2)工业上制取氯酸钠采用在热的石灰乳通入氯气,然
后结晶除去氯化钙后,再加入一种钠盐,合适的钠盐是
。
(3)北美、欧洲国家生产氯酸钠用二级精制盐水。采用
无隔膜电解法获得,生产过程中涉及的主要的化学反应式如下:
总反应式:NaC1+3H2O NaC1O3+3H2↑
NaC1O3+3H2↑
阳极:2C1——2e— C12↑阴极:2H2O+2e— H2↑+2OH—
液相反应:C12+H2O HC1O+H++C1— HC1O
HC1O+H++C1— HC1O H++C1O—
H++C1O—
2HC1O+CO— C1O3—+2C1—+2H+
精制食盐水时,要除去其中的Ca2+、Mg2+及SO42—并得到中性溶液,依次加入的化学试剂
是 、 、 ;过滤,滤液中再加入适量的稀盐酸,得一级精制盐水再经离子交换处理或膜处理得到二级精制盐水。
②电解时,必须在食盐水中加入Na2Cr2O7,其目的是防止 (填离子符号)电解过程中在阴极上放电。
(4)若NaC1O3与KC1的混合溶液中NaC1O3与KC1的质量分数分别为0.290和0.203(相关物质的溶解度曲线如右图)。从混合溶液中获得较多KC1O3晶体的实验操作依次
为 (填操作名称)、干燥。
(5)样品中C1O3—的含量可用滴定法进行测定,实验步骤
如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液。
步骤2:从上述容量瓶中取出10.00mL于锥形瓶中,准确加入25mL1000mol/L(NH4)2Fe(SO4)2。溶液(过量),加入75mL硫酸和磷酸配成的混酸,静置10min。
步骤3:再在锥形瓶中加入100mL蒸馏水及某种氧化还原反应指示剂,用0.200mol/LK2Cr2O7标准溶液滴定至终点。
步骤4: 。
步骤5:数据处理与计算。
①步骤2,静置10min的目的是 。
②步骤3中K2Cr2O2标准溶液应盛放在 中(填仪器名称)。
③为了确定样品中C1O3—的质量分数,步骤4的操作内容是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com