
题目列表(包括答案和解析)
A.标准状况下,11.2 L氯仿中所含氯原子为0.75 NA
B.56 g铁与标准状况下33.6 L氯气充分反应时,铁失去的电子数为3 NA
C.在20℃,1.01×105 Pa时,2.8gC2H4和CO的混合气体中的分子数为0.1 NA
D.46 g NO2和46 g N2O4中含有的原子数目均为3 NA
(12分)过碳酸钠(2Na2CO3·3H2O2)俗称固体双氧水,是一种很好的消毒剂和供氧剂(有活性氧存在),被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,它的制备原理和路线如下(图中BC—1、BC—2均为稳定剂):
2Na2CO3 + 3H2O2 → 2 Na2CO3·3H2O2 △H<0
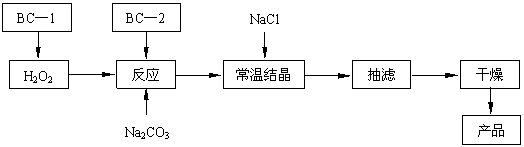 |
回答下列问题:
⑴过碳酸钠用作消毒剂时,其消毒机理与下列 (填写序号) 物质相似。
A.75%酒精 B.苯酚 C. KMnO4稀溶液 D.84 消毒液(NaClO溶液)
⑵结晶过程中加入氯化钠搅拌的作用是 。
⑶加入BC—2稳定剂与工业纯碱中含有的Fe3+杂质生成稳定的配合物的目的是 。
⑷由实验测定反应温度对产物的影响如下表:
| T/°C | 活性氧百分含量 | 产率 |
| 5~10 | 13.94 | 85.49 |
| 10~15 | 14.02 | 85.78 |
| 15~20 | 15.05 | 88.38 |
| 20~25 | 14.46 | 83.01 |
根据上表数据,你认为反应最佳的温度选择的范围是 。
⑸以上生产流程中遗漏了一步,造成所得产品纯度偏低,该步操作的名称是 。
⑹过碳酸钠极易分解,则产生6.72LO2(标况)需过碳酸钠 g。
|
某同学在实验报告中记录下列数据,其中正确的是 | |
| [ ] | |
A. |
用托盘天平称量8.75 g食盐 |
B. |
用500 ml的容量瓶配制480 ml溶液 |
C. |
用10 ml量筒量取6.46 ml盐酸 |
D. |
用广泛pH试纸测得某溶液的pH为4.5 |
 (2013?绍兴二模)苯甲酸乙酯(C9H10O2)(Mr=150)(密度1.05g?cm-3)稍有水果气味,用于配制香水香精和人造精油;也大量用于食品中,也可用作有机合成中间体、溶剂如纤维素酯、纤维素醚、树脂等.可能用到的数据:
(2013?绍兴二模)苯甲酸乙酯(C9H10O2)(Mr=150)(密度1.05g?cm-3)稍有水果气味,用于配制香水香精和人造精油;也大量用于食品中,也可用作有机合成中间体、溶剂如纤维素酯、纤维素醚、树脂等.可能用到的数据:| 沸点(℃,1atm) | ||||||
| 苯甲酸 | 苯甲酸乙酯 | 石油醚 | 水 | 乙醇 | 环己烷 | 共沸物(环已烷-水-乙醇) |
| 249 | 212.6 | 40-80 | 100 | 78.3 | 80.75 | 62.6 |

单质A与氟以19的摩尔比在室温、高压(约为一兆帕)下混合、加热到900℃时有三种化合物B、C和D形成,其摩尔质量递增。它们都是熔点低于150℃的晶体。测得C中含氟量为36.7%(重量)、D中含氟量为46.5%(重量)。用无水氟磺酸在-75℃处理B时,形成化合物E和HF。E为晶体,在0℃时可稳定数周,但在室温只要几天就分解了。
1.通过计算或讨论,确定X的元素符号;
2.写出B、C、D的化学式和E的结构简式
3.根据价电子层电子互斥理论(VSEPR),B和C分子的几何构型各是什么?
4.使开始得到的B、C和D的混合物水解。B水解时放出A和O2,并且形成氟化氢水溶液。C水解时放出A和O2(摩尔比为43),并形成含有氧化物AO3和氟化氢的水溶液。D水解没有气体放出。写出三水解作用的反应方程式。
5.AO3具有强氧化性,可以将Mn2+氧化为KMnO4,写出离子反应方程式。
6.把B、C、D混合物完全水解以测定组成。用水处理一份混合物样品时,放出60.2mL气体(在290K和100kPa下测定的),这一气体中含有O2 40.0%(体积)。用0.100mol/L FeSO4水溶液滴定以测定水中AO3含量,共用36.0mL FeSO4溶液。计算原始B、C、D混合物的物质的量之比。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com