
题目列表(包括答案和解析)
 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:| 压强转化率温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
| 500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
| 600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
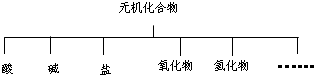
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ②______ | ③NaOH ④KOH | ⑤Na2SO4 ⑥______ | ⑦SO2 ⑧SO3 | ⑨NH3 |
 H2CO3+OH-
H2CO3+OH- H2CO3+OH-
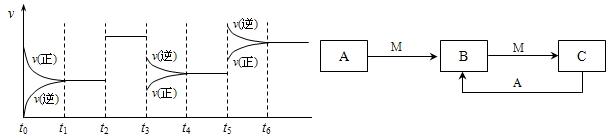
H2CO3+OH- 2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是 2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m.
2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m. (10分)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示S形成硫酸酸雨的反应方程式 , 。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是 。
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣),n(HSO3﹣)变化关系如下表:
| n(SO3²﹣):,n(HSO3﹣) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |



(10分)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示S形成硫酸酸雨的反应方程式 , 。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是 。
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣),n(HSO3﹣)变化关系如下表:
|
n(SO3²﹣):,n(HSO3﹣) |
91:9 |
1:1 |
1:91 |
|
PH |
8.2 |
7.2 |
6.2 |
①上表判断NaHSO3溶液显 性,用化学平衡原理解释:
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
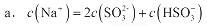

(4)当吸收液的pH降至约为6时,送至电解槽再生。再生示意图如下:
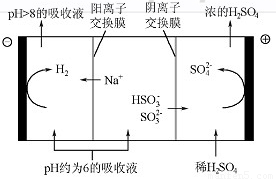
①HSO3-在阳极放电的电极反应式是 。
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用。简述再生原理:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com