
题目列表(包括答案和解析)

 2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表: 
 N2(g)+3H2(g)的化学平衡常数的值为___
N2(g)+3H2(g)的化学平衡常数的值为___ 2SO3(g) △H<0某温度下,SO2的平衡转化率(a)与体系总压强(p)的关系如下图所示。根据图示回答下列问题:
2SO3(g) △H<0某温度下,SO2的平衡转化率(a)与体系总压强(p)的关系如下图所示。根据图示回答下列问题: 
Ⅰ.800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应CO(g)+H2O(g) H2(g)+CO2(g),反应过程中测定的部分数据见下表:
H2(g)+CO2(g),反应过程中测定的部分数据见下表:
|
反应时间/min |
0 |
2 |
4 |
6 |
|
n(CO)/mol |
1.20 |
0.90 |
|
0.80 |
|
n(H2O)/ mol |
0.60 |
|
0.20 |
|
①反应在2 min内的平均速率为v(H2O)=___________;
②800℃时,化学平衡常数K的值为_______________;
③保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率______(填“增大”或“减小”或“不变”)。
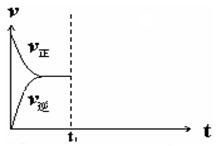
④在恒温恒压密闭容器中通入CO和H2O各1 mol发生该反应,当反应达到平衡后,维持温度与压强不变,t1时再通入各1 mol的CO和H2O的混合气体,请在右图中画出正(v正)、逆(v逆)反应速率在t1后随时间t变化的曲线图。

Ⅱ.实验室中利用复分解反应制取Mg(OH)2。实验数据和现象如下表所示(溶液体积均取用1mL):
|
组别 |
药品1 |
药品2 |
实验现象 |
|
I |
0.01 mol/L NaOH溶液 |
0.01 mol/L MgCl2溶液 |
生成白色沉淀 |
|
II |
0.01 mol/L氨水 |
0.01 mol/L MgCl2溶液 |
无现象 |
|
III |
0.1 mol/L氨水 |
0.1 mol/L MgCl2溶液 |
现象III |
|
IV |
0.1 mol/L氨水 |
0.01 mol/L MgCl2溶液 |
生成白色沉淀 |
|
V |
0.01 mol/L氨水 |
0.1 mol/L MgCl2溶液 |
无现象 |
①现象III是 ;
②如果向0.028 mol/L的MgCl2溶液中加入等体积的NaOH溶液,请计算NaOH溶液的浓度至少达到
mol/L时,溶液中开始出现白色沉淀(Ksp(Mg(OH)2)= 5.6×10-12)。
③MgCl2溶液和氨水混合后存在下列化学平衡:Mg2+(aq)
+ 2NH3·H2O(aq) 2NH4+(aq)
+ Mg(OH)2(s)该反应化学平衡常数的表达式为K=
,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式
。
2NH4+(aq)
+ Mg(OH)2(s)该反应化学平衡常数的表达式为K=
,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式
。
Ⅰ.800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应CO(g)+H2O(g) H2(g)+CO2(g),反应过程中测定的部分数据见下表:
H2(g)+CO2(g),反应过程中测定的部分数据见下表:
| 反应时间/min | 0 | 2 | 4 | 6 |
| n(CO)/mol | 1.20 | 0.90 | | 0.80 |
| n(H2O)/ mol | 0.60 | | 0.20 | |
| 组别 | 药品1 | 药品2 | 实验现象 |
| I | 0.01 mol/L NaOH溶液 | 0.01 mol/L MgCl2溶液 | 生成白色沉淀 |
| II | 0.01 mol/L氨水 | 0.01 mol/L MgCl2溶液 | 无现象 |
| III | 0.1 mol/L氨水 | 0.1 mol/L MgCl2溶液 | 现象III |
| IV | 0.1 mol/L氨水 | 0.01 mol/L MgCl2溶液 | 生成白色沉淀 |
| V | 0.01 mol/L氨水 | 0.1 mol/L MgCl2溶液 | 无现象 |
 2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。
2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。 H2(g)+CO2(g),反应过程中测定的部分数据见下表:
H2(g)+CO2(g),反应过程中测定的部分数据见下表:| 反应时间/min | 0 | 2 | 4 | 6 |
| n(CO)/mol | 1.20 | 0.90 | | 0.80 |
| n(H2O)/ mol | 0.60 | | 0.20 | |

| 组别 | 药品1 | 药品2 | 实验现象 |
| I | 0.01 mol/L NaOH溶液 | 0.01 mol/L MgCl2溶液 | 生成白色沉淀 |
| II | 0.01 mol/L氨水 | 0.01 mol/L MgCl2溶液 | 无现象 |
| III | 0.1 mol/L氨水 | 0.1 mol/L MgCl2溶液 | 现象III |
| IV | 0.1 mol/L氨水 | 0.01 mol/L MgCl2溶液 | 生成白色沉淀 |
| V | 0.01 mol/L氨水 | 0.1 mol/L MgCl2溶液 | 无现象 |
 2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。
2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。图一是煤化工产业链的一部分,试运用所学知识,回答下列问题:
图一
(1)图一中气体A的俗称是_______________
(2)合成氨工业是煤化工产业链中非常重要的一步。已知有一组数据:破坏1mol氮气中的化学键需要吸收946 kJ能量;破坏0.5mol氢气中的H-H键需要吸收218kJ的能量;形成氨分子中1 mol N-H键能够释放389kJ能量。图二表示合成氨工业过程中能量的变化,请将图中①、②的能量变化的数值,填在下边的横线上。 
图二
① kJ ,② kJ
(3)煤化工产业的重要产品之一甲醇,是一种新型的汽车动力燃料,发达国家等一般通过CO和H2化合制备甲醇,该反应的化学方程式为:CO (g) + 2H2(g) CH3OH(g)
CH3OH(g)
①下列描述中能说明上述反应已达平衡的是_______;
A. 容器内气体的平均摩尔质量保持不变
B. 2v(H2)正 = v(CH3OH)逆
C. 容器中气体的压强保持不变
D. 单位时间内生成n molCO的同时生成2n mol H2
②在容积固定的恒温密闭容器中充入CO和H2发生上述反应,反应在第4 min时候达到其限度,此时容器中压强与反应前之比为3︰5,容器内物质的各种物质的量浓度如下表:
| 时间/浓度 | c(CO)(mol/L) | C(H2 )(mol/L) | c(CH3OH)(mol/L) |
| 起始 | 0.200 | 0.300 | 0.000 |
| 第4 min | a | b | c |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com