
题目列表(包括答案和解析)
| 水的质量(g) | 10 | 50 | 100 |
| KNO3的质量(g) | 3.2 | 15.8 | 31.6 |
| 温度(℃) | 20 | 40 | 60 |
| KNO3的质量(g) | 6.3 | 12.8 | 22.0 |

| 步骤 | 实验操作 | 实验结果 |
| 1 | 取100mL水,加入20g硝酸钾,搅拌,恢复至20℃ | 全部溶解,得溶液① |
| 2 | 再加11.6g硝酸钾,搅拌,恢复至20℃ | 恰好饱和,得溶液② |
| 3 | 再加20g硝酸钾,搅拌,恢复至20℃ | 得溶液③ |
| 4 | 加热 | 全部溶解,得溶液④ |
| 5 | 冷却至20℃ | 析出晶体,得溶液⑤ |
硝酸钾是农业上常用的一种化肥,能够使农作物枝叶繁茂、增强抗倒伏、抗病虫害的能力,硝酸钾属于化肥中的______.硝酸钾与任何酸、碱、盐都不会发生复分解反应,其原因是______.
(1)为了探究硝酸钾固体在水中溶解质量多少的影响因素,某研究小组开展了以下的探究活动,请你根据实验数据归纳出结论.
实验一:KNO3在20℃水中达到饱和时溶解的质量
| 水的质量(g) | 10 | 50 | 100 |
| KNO3的质量(g) | 3.2 | 15.8 | 31.6 |
结论:当______相同时,水的质量越多,溶解KNO3的质量越多.
实验二:KNO3在20g水中达到饱和时溶解的质量
| 温度(℃) | 20 | 40 | 60 |
| KNO3的质量(g) | 6.3 | 12.8 | 22.0 |
结论:当水的质量相同时,______.
讨论:如果是气体物质,除上述因素外,影响其在水中溶解质量多少的因素还有______(写一种).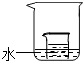
(2)如图所示,小烧杯中盛放的是硝酸钾饱和溶液.若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,一定能够使小烧杯中有固体析出的是______(填字母).
A.冰块 B.浓硫酸 C.硝酸铵 D.氢氧化钠E.氧化钙
(3)请根据下列实验回答问题:(已知水的密度为1g/cm3)
| 步骤 | 实验操作 | 实验结果 |
| 1 | 取100mL水,加入20g硝酸钾,搅拌,恢复至20℃ | 全部溶解,得溶液① |
| 2 | 再加11.6g硝酸钾,搅拌,恢复至20℃ | 恰好饱和,得溶液② |
| 3 | 再加20g硝酸钾,搅拌,恢复至20℃ | 得溶液③ |
| 4 | 加热 | 全部溶解,得溶液④ |
| 5 | 冷却至20℃ | 析出晶体,得溶液⑤ |
①步骤1中所得溶液的质量为______g;
②上述溶液①~⑤中,一定不属于饱和溶液的是______(填溶液的序号),溶质质量分数一定相等的是______(填溶液的序号);
③步骤5中,析出晶体的质量为(选填下列编号)______.
Ⅰ.20g Ⅱ.31.6g Ⅲ.51.6g.
硝酸钾是农业上常用的一种化肥,能够使农作物枝叶繁茂、增强抗倒伏、抗病虫害的能力,硝酸钾属于化肥中的 。硝酸钾与任何酸、碱、盐都不会发生复分解反应,其原因是 。
(1)为了探究硝酸钾固体在水中溶解质量多少的影响因素,某研究小组开展了以下的探究活动,请你根据实验数据归纳出结论。
实验一: KNO3在20℃水中达到饱和时溶解的质量
| 水的质量(g) | 10 | 50 | 100 |
| KNO3的质量(g) | 3.2 | 15.8 | 31.6 |
| 温度(℃) | 20 | 40 | 60 |
| KNO3的质量(g) | 6.3 | 12.8 | 22.0 |
| 实验操作 | 实验现象和溶解程度 | 实验结果 |
| 取100mL水,加入25g硝酸钾,搅拌,恢复至20°C | 全部溶解 | 得溶液① |
| 再加w g硝酸钾,搅拌,恢复至20°C | 恰好饱和 | 得溶液② |
| 再加25g硝酸钾,搅拌,恢复至20°C | 不溶解 | 得溶液③ |
| 加热 | 全部溶解 | 得溶液④ |
| 冷却至20°C | 析出晶体a | 得溶液⑤ |
| 蒸发掉10g水,恢复至20°C | 析出晶体b | 得溶液⑥ |
| 水的质量(g) | 10 | 50 | 100 |
| KNO3的质量(g) | 3.2 | 15.8 | 31.6 |
| 温度(℃) | 20 | 40 | 60 |
| KNO3的质量(g) | 6.3 | 12.8 | 22.0 |
| 步骤 | 实验操作 | 实验结果 |
| 1 | 取100mL水,加入20g硝酸钾,搅拌,恢复至20℃ | 全部溶解,得溶液① |
| 2 | 再加11.6g硝酸钾,搅拌,恢复至20℃ | 恰好饱和,得溶液② |
| 3 | 再加20g硝酸钾,搅拌,恢复至20℃ | 得溶液③ |
| 4 | 加热 | 全部溶解,得溶液④ |
| 5 | 冷却至20℃ | 析出晶体,得溶液⑤ |

| 水的质量(g) | 10 | 50 | 100 |
| KNO3的质量(g) | 3.2 | 15.8 | 31.6 |
| 温度(℃) | 20 | 40 | 60 |
| KNO3的质量(g) | 6.3 | 12.8 | 22.0 |
| 实验操作 | 实验现象和溶解程度 | 实验结果 |
| 取100mL水,加入25g硝酸钾,搅拌,恢复至20°C | 全部溶解 | 得溶液① |
| 再加w g硝酸钾,搅拌,恢复至20°C | 恰好饱和 | 得溶液② |
| 再加25g硝酸钾,搅拌,恢复至20°C | 不溶解 | 得溶液③ |
| 加热 | 全部溶解 | 得溶液④ |
| 冷却至20°C | 析出晶体a | 得溶液⑤ |
| 蒸发掉10g水,恢复至20°C | 析出晶体b | 得溶液⑥ |
一、选择
1
2
3
4
5
6
7
8
9
10
11
12
B
B
C
B
C
C
C
D
D
A
D
B
二、填空
13.⑴小于 ⑵加入适量甲物质(降温或蒸发溶剂至少量晶体析出)⑶饱和 等于
14.(1)
15.B>C>A(或B、C、A或BCA); 65;B>C>A(或B、C、A或BCA)
16.温度升高,气体的溶解度降低,使水中溶解的氧气量减少;适当降低水的温度,不断通入空气,增大氧气在水中溶解的程度
17.(1)10;(2)甲的溶解度>乙的溶解度;(3)加溶剂(或加水或升温); (4)降温结晶(或冷却热饱和溶液)(每空1分)
(4)降温结晶(或冷却热饱和溶液)(每空1分)
三、简答
19.饱和石灰水升温时,会有固体析出,向饱和石灰水中通入一定量的CO2,会有白色沉淀出现。 原因:饱和石灰水升温,由于Ca(OH)2的溶解度随温度的升高而减小,所以会有固体析出,向饱和石灰水中通入CO2会有沉淀出现,Ca(OH)2+CO2=CaCO3↓+H2O
20.因为饱和氯化钠溶液不能再溶解氯化钠固体,但可以溶解氯化钙、氯化镁等其他杂质, 故可以精制食盐
故可以精制食盐
四、实验与探究
21.(1)右 加速固体溶解 (2) ⑤ ①(3)
22. (1)C (2)C (3)t3 (4)A=B>C
23. B
五、计算
24. 80% ,10%
本资料由《七彩教育网》www.7caiedu.cn 提供!
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com