
题目列表(包括答案和解析)

| ||
| ||
实验序号 | 固体混合物(A) | 加入蒸馏水 | 加入试剂(B) | 过滤、洗涤、干燥,得固体(C) | 蒸发滤液得到晶体(D) | 需称量的物质 |
Ⅰ | BaCl2、NaCl | 溶解 | 过量CO2 | — | D | A、D |
Ⅱ | CaCl2、NaCl | 溶解 | 过量饱和Na2CO3溶液 | CaCO3 | NaCl | A、C |
Ⅲ | Na2SO4、MgSO4 | 溶解 |
|
|
|
|
试回答下列问题:
(1)实验Ⅰ中D的成分是____________,称量后____________(填“能”或“不能”)通过计算得到A中各组分的质量比。
(2)实验Ⅱ填写的内容中明显错误的是____________,其原因是_____________________。
(3)对实验Ⅲ进行设计,并将相应内容填入Ⅲ中对应的空格内,最终能得出A中各组分的质量比为:(用含字母的表达式表示)_____________________________________________。
(16分)碳和碳的化合物在生产生活实际中应用广泛。运用化学反应原理研究碳的氧化物的性质具有重要意义。
(1)常温下,碳酸在水中的电离常数Ka1=4.2×10-7 ,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka=4.7×10-8。写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入二氧化碳发生反应的离子方程式 ;
(2)上图为常用笔记本电脑所用的甲醇质子交换膜燃料电池的结构示意图。电池总反应为2CH3OH+3O22CO2+4H2O。该装置放电时 (填“a”或“b”)为电池的负极,其电极反应式为 ;
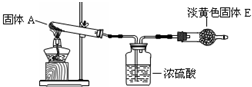
(3)CO具有还原性,某化学研究小组为证明CO具有还原性,设计了如图所示的实验装置。
已知:C + H2OCO+H2 CO + H2O
CO2 + H2 C + CO2
2CO
试回答下列问题:
① 装置B中最适宜的试剂是 ,必须用装置C吸收气体中的水蒸气的理由是 ;
② 根据该实验中的 现象,可证明CO具有还原性;
③ 若要根据装置F中石灰水变浑浊的现象准确确认CO具有还原性,则应在上图装置 与 之间(填字母标号)连接下图中的 装置(选填序号)。
硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等。
(1)新制的绿矾(FeSO4·7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式:??????????????????????????????????????????????? 。
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;
SO3熔点是16.8℃,沸点是44.8℃。
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”。

上述装置Ⅲ和Ⅳ用来检验气体产物。试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在????? (选填“0℃、25℃、50℃”),装置Ⅱ的作用是??????????? 。
②装置Ⅲ中的试剂可以是??????? (选填序号,下同),现象是????????????? ,则证明气体产物中含有SO2; 装置Ⅳ中的试剂可以是????????? 。
A. 2 mol/LNa2CO3溶液
B. 品红溶液
C. 0.5 mol/L BaCl2溶液?
D. 0.5 mol/LBa(NO3)2
E. 0.01 mol/L KMnO4溶液
F. 淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为??????????????????????????? 。
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如
下实验:
操作步骤 | 预期实验现象 | 预期实验结论 |
向其中一份溶液中加入??? ?????????? 。 | ? ????????????????????????? | ????? 固体中含有Fe2O3 |
向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液。 | ???????? 产生蓝色沉淀 | ?????????????????????????? |
⑤若用22.8 g FeSO4固体做实验,完全分解后,得到11.2 g固体,其中Fe2O3的质量分数=??????????
(精确到0.1%)
一、二选择题(每小题3分,共45分)
1-5.DCAAC 6-10.ACDCC 11.CD 12.C 13.AD 14.AC 15.C
第Ⅱ卷(非选择题,共55分)
|