
题目列表(包括答案和解析)
某温度时,在2L的容器中X、Y、Z三种气体的物质的量随着时间的变化曲线如下图所示,下图中数据分析完成下列问题:
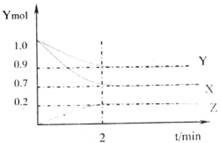
(1)由图中的数据分析该反应的化学方程式为___________________________
(2)前两分钟内,Z的平均反应速率为__________________________________
 某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析: 2Z
2Z 2Z
2Z(16分)某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图(2)所示。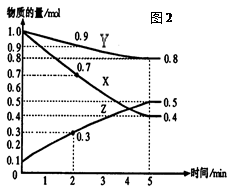
(1)由图中的数据分析,该反应的化学方程式为 。
(2)反应开始至5min,Z的平均反应速率为 ;
(3)反应开始至5min ,正反应速率逐渐 ;逆反应速率逐渐 , 5min后Z的物质的量不再改变,原因是下列的 ;
A.正逆反应都停止了
B.正反应速率为零
C.正逆反应速率相等,反应达到平衡状态
D.逆反应速率为零
(4)下列措施能使正反应速率增大的是
A.升高温度 B.降低温度
C.增大Y的浓度 D.减少Z的浓度
(16分)某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图(2)所示。
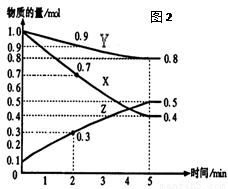
(1)由图中的数据分析,该反应的化学方程式为 。
(2)反应开始至5min,Z的平均反应速率为 ;
(3)反应开始至5min ,正反应速率逐渐 ;逆反应速率逐渐 , 5min后Z的物质的量不再改变,原因是下列的 ;
A.正逆反应都停止了
B.正反应速率为零
C.正逆反应速率相等,反应达到平衡状态
D.逆反应速率为零
(4)下列措施能使正反应速率增大的是
A.升高温度 B.降低温度
C.增大Y的浓度 D.减少Z的浓度
(9分)某温度时,在2L容器中X、Y、Z三种气体及N物质的物质的量(n)随着时间(t)变化的曲线如图所示。 由图中数据分析:
由图中数据分析:
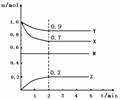
 (1)物质N在反应中的作用是 。
(1)物质N在反应中的作用是 。
(2)该反应的化学方程式为 。
(3)反应开始至2min,用Z表示的平均反应速率为 。
 (4)下列叙述能说明上述反应达到平衡状态的是________ _______(填序号)
(4)下列叙述能说明上述反应达到平衡状态的是________ _______(填序号)
A.混合气体的压强不随时间的变化而变化
 B.单位时间内每消耗3 mol X,同时生成2 mol Z
B.单位时间内每消耗3 mol X,同时生成2 mol Z
C.混合气体的总质量不随时间的变化而变化
 D.混合气体的总物质的量不随时间的变化而变化
D.混合气体的总物质的量不随时间的变化而变化
选择题答案:
l
2
3
4
5
6
7
8
9
10
D
C
C
C
A
A
B
B
B
B
11
12
13
14
15
16
17
18
19
20
C D
B D
C
B
A
A
A D
C D
B D
B
三、共23分
21.每个空1分:化学能 电能 不会污染环境 0
22.每个空2分:3X+Y.files/image010.jpg) 2Z (不写可逆号扣1分)
2Z (不写可逆号扣1分)
0.05mol?L.files/image035.gif) ?min
?min.files/image035.gif) (不写单位或写错单位不得分)
(不写单位或写错单位不得分)
23.
.files/image038.jpg)
每个空1分(电荷不守恒的扣2分)
电极名称
电极反应式
电极反应类型
正极
2Cu2++4e.files/image006.gif) =2Cu
=2Cu
还原反应
负极
2Zn-4e.files/image006.gif) =2Zn2+
=2Zn2+
氧化反应
阳极
4OH.files/image006.gif) -4e
-4e.files/image006.gif) =O2↑+2H2O
=O2↑+2H2O
氧化反应
阴极
4H++4e.files/image006.gif) =2H2↑
=2H2↑
还原反应
24.每个空1分:
(1)强酸性(不注明“强”的不得分) 2H++2e.files/image006.gif) =H2↑ Fe-2e
=H2↑ Fe-2e.files/image006.gif) =Fe2+
=Fe2+
(2)中性或弱酸性(答不全不得分) O2+4e.files/image006.gif) +2H2O==4OH
+2H2O==4OH.files/image006.gif) 2Fe-4e
2Fe-4e.files/image006.gif) ==2Fe2+
==2Fe2+
(两个电极反应式的电荷不守恒不得分)
四、共18分
25.(1)每个空1分:铁(Fe) 石墨(其它答案不得分)
Fe-2e.files/image006.gif) +2OH
+2OH.files/image006.gif) =Fe(OH)2↓ 2H++2e
=Fe(OH)2↓ 2H++2e.files/image006.gif) =H2↑
=H2↑
(2)B C (选对一个得1分,选对2个得2分,选错一个得0分)
(3)每个空1分:隔绝空气,防止生成的氢氧亚化铁被氧化 加热煮沸 排出溶液中的空气(氧气)
(4)B C (选对一个得1分,选对2个得2分,选错一个得0分)
26..files/image042.gif)
(表中每个空1分)
m
a
y
1
0.25
16.67%
2
0.45
21.43%
3
0.56
19.35%
2:1 (1分)
由表中的数据可知,开始m增大时,y也随之增大;当m>2时,m增大时,y又随之减小,m=2时,y为最大值 (2分)
五、共9分
27.(3分)2:3:1
28.解:△S(298K)=169.6J/(mol?K)=0.1696KJ/(mol?K)…………(1分)
△G=AH(298K)-T?△S(298K)…………………………………(1分)
=178.3KJ/mol-T×0.1696KJ/(mol?K)<0……………(1分)
故:T>178.3KJ/mol÷0.1696KJ/(mol?K)=1051.3K…………(1分)
所以碳酸钙分解的最低温度为1051.3K……………………………(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com