
题目列表(包括答案和解析)
100℃时,在1L恒温恒容的密闭容器中,通入0.1
mol N2O4,发生反应:N2O4(g)
 2NO2(g);△H= +57.0 kJ·mol-1,NO2和N2O4的浓度如图甲所示。NO2和N2O4的消耗速率与其浓度的关系如乙图所示,
2NO2(g);△H= +57.0 kJ·mol-1,NO2和N2O4的浓度如图甲所示。NO2和N2O4的消耗速率与其浓度的关系如乙图所示,
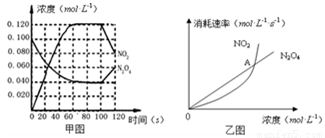
(1)在0~60s内,以N2O4表示的平均反应速率为 mol·L-1·s-1 。
(2)根据甲图中有关数据,计算100℃时该反应的平衡常数K1= =0.36mol.L-1.S-1
若其他条件不变,升高温度至120℃,达到新平衡的常数是k2 ,则k1 k2 (填“>”、“<”或“=”)。(3)反应进行到100s时,若有一项条件发生变化,变化的条件可能是 。
A.降低温度 B.通入氦气使其压强增大 C.又往容器中充入N2O4 D.增加容器体积
(4)乙图中, 交点A表示该反应的所处的状态为 。
A.平衡状态 B.朝正反应方向移动 C.朝逆反应方向移动 D.无法判断
(5)已知N2(g)+2O2(g)=2NO2(g) △H= +67.2 kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H= -534.7 kJ·mol-1
N2O4(g)  2NO2(g)
△H= +57.0 kJ·mol-1
2NO2(g)
△H= +57.0 kJ·mol-1
则2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H= kJ·mol-1
100℃时,在1L恒温恒容的密闭容器中,通入0.1 mol N2O4,发生反应:N2O4(g)  2NO2(g);△H=" +57.0" kJ·mol-1,NO2和N2O4的浓度如图甲所示。NO2和N2O4的消耗速率与其浓度的关系如乙图所示,
2NO2(g);△H=" +57.0" kJ·mol-1,NO2和N2O4的浓度如图甲所示。NO2和N2O4的消耗速率与其浓度的关系如乙图所示,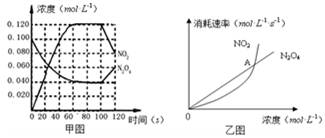
(1)在0~60s内,以N2O4表示的平均反应速率为 mol·L-1·s-1。
(2)根据甲图中有关数据,计算100℃时该反应的平衡常数K1= =0.36mol.L-1.S-1
若其他条件不变,升高温度至120℃,达到新平衡的常数是k2,则k1 k2(填“>”、“<”或“=”)。(3)反应进行到100s时,若有一项条件发生变化,变化的条件可能是 。
A.降低温度 B.通入氦气使其压强增大 C.又往容器中充入N2O4 D.增加容器体积
(4)乙图中, 交点A表示该反应的所处的状态为 。
A.平衡状态 B.朝正反应方向移动 C.朝逆反应方向移动 D.无法判断
(5)已知N2(g)+2O2(g)=2NO2(g) △H=" +67.2" kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=" -534.7" kJ·mol-1
N2O4(g)  2NO2(g) △H=" +57.0" kJ·mol-1
2NO2(g) △H=" +57.0" kJ·mol-1
则2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H= kJ·mol-1
 2NO2(g);△H=" +57.0" kJ·mol-1,NO2和N2O4的浓度如图甲所示。NO2和N2O4的消耗速率与其浓度的关系如乙图所示,
2NO2(g);△H=" +57.0" kJ·mol-1,NO2和N2O4的浓度如图甲所示。NO2和N2O4的消耗速率与其浓度的关系如乙图所示,
 2NO2(g) △H=" +57.0" kJ·mol-1
2NO2(g) △H=" +57.0" kJ·mol-1 恒温恒容的条件下,在密闭容器中按不同方式投入反应物,均达到平衡,测得平衡时的有关数据如下(已知:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1):
①c1=c2 ②c3=2c2 ③Q1=Q2 ④Q1+Q2=92.4 ⑤p1=p2 ⑥a2>a3. |
| A、①④⑤⑥ | B、①③⑤⑥ |
| C、①②③⑥ | D、②③⑤⑥ |
| 反应物投入量 | NH3的浓度 (mol?L-1) |
反应的 能量变化 |
体系压强 (Pa) |
反应物 转化率 | |
| 甲 | 1mol N2、3mol H2 | c1 | 放出a kJ | p1 | α1 |
| 乙 | 2mol NH3 | c2 | 吸收b kJ | p2 | α2 |
| A、c1=c2 |
| B、a+b=1 |
| C、p1>p2 |
| D、α1+α2>1 |
一、选择题(每小题3分,共51分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
答案
A
C
C
C
C
C
B
D
A
B
B
D
B
C
A
C
D
二、填空题(21题(1)问每空1分,其余每空2分,共19分)
18.(10分)(1)① (2)①⑤ (3)4 (4)>7 (5)D
19.(8分)(1)

(2)
(3)
 20.(9分)(1)
20.(9分)(1)

 (各1分)
(各1分)
(2)
(3) (4)
(4)

21.(14分)(1)试管上部充满红棕色气体
(2)无; 与水反应生成了足量的
与水反应生成了足量的 ,中和了
,中和了
(3)
 只写第一个给全分
只写第一个给全分
(4) ;
; ;小
;小
22.(8分)(1)
(2)A、D
(3)3 

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com