
题目列表(包括答案和解析)
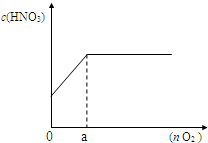
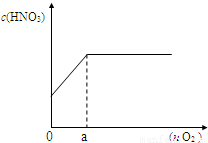
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就硫酸、硝酸与金属铜反应的情况,回答下列问题:
⑴工业上制备硫酸铜是利用废铜屑经灼烧后,在加热情况下跟稀硫酸反应,有关的化学方程
式是: 。
不采用铜跟浓硫酸反应来制取硫酸铜的原因是
。
⑵在一定体积的10 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9 mol。则浓硫酸的实际体积 (填“大于”、“等于”或“小于”)180 mL。
⑶若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为 。
⑷将8 g Fe2O3投入到150 mL某浓度的稀硫酸中,再投入7 g铁粉,充分反应后,收集到1.68 L H2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4 mol·L-1的NaOH溶液150 mL。则原硫酸的物质的量浓度为 。
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入5 mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如下图所示。则

⑴B与A的差值为 mol。
⑵C点对应的溶液体积为 mL。
⑶原硝酸溶液中含硝酸的物质的量为 mol。
⑷铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为 。
⑸写出铝与该浓度硝酸反应的离子方程式 。
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入5 mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如下图所示。则
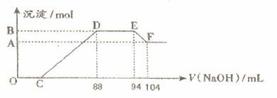
⑴B与A的差值为 mol。
⑵C点对应的溶液体积为 mL。
⑶原硝酸溶液中含硝酸的物质的量为 mol。
⑷铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为 。
⑸写出铝与该浓度硝酸反应的离子方程式 。
1.D 2.C 3.D 4.B 5.B 6.D 7.C 8.C 9.D 10.B
11.B 12.D 13.D 14.C 15.B 16.D 17.A 18.B 19.D 20.B
21(共7分).(1)略 (1分)
极性 (1分) (2) H2O2 H++HO2- (1分)
H2O2+2OH-=O22-+2H2O(1分)
H++HO2- (1分)
H2O2+2OH-=O22-+2H2O(1分)
(3)H2O2+SO2=2H++SO42-(2分)
(4)ABC(1分)
22(共7分).(1)MgO 、C (1分) MgO(1分)
(2)小(1分), 在液态水中,几个水分子间存在氢键,在冰中,水分子大范围地以氢键相互 联结,形成相当疏松的晶体,使体积膨胀,密度减小。(1分)
(3) 4NH3+5O2=4NO+6H2O (1分) 2NH3 + 3CuO 3Cu + 3H2O + N2(2分)
3Cu + 3H2O + N2(2分)
23.(共9分)(1)①两支试管中都产生大量气泡,但盛NaHCO3的试管中反应速率要快得多(1分)
②约为53/42;(1分) ③不正确 (1分)
⑵ ①《NaHCO3、Na2CO3 和盐酸反应过程中热效应的研究》(1分)
②托盘天平(1分)、温度计;(1分)
a吸热(1分) b:放热 (1分) c:NaHCO3溶解和NaHCO3与盐酸反应(1分)
24.(共14分)(1)Fe2O3 (1分) (2)D(1分)
(3)①氢氧化铁胶体,(1分)先产生红褐色沉淀,后沉淀逐渐溶解,溶液变成黄色且有气泡产生(1分)Fe3+ + 3SCN- == Fe(SCN)3 (1分)
Ba2+ + SO42- == BaSO4↓(1分)
②Fe3+与SO32-同时发生氧化还原反应和双水解反应(2分)
③2Fe3+ + 3CO32- + 3H2O == 2Fe(OH)3↓+ 3CO2↑(2分)
④SO32-有较强的还原性,CO32-没有还原性(1分);SO32-水解能力较CO32-小(1分)
(4)4-21mO
 2mFe
(2分)
2mFe
(2分)
25.(共8分)(1)so2(1分)
(2)30(2分)
(3)CaC2+2H2O→Ca(OH)2+C2H2(2分)
(4)N2\CO\C2H4(各1分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com