
题目列表(包括答案和解析)
(共14分)下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,X受热分解所得气体在标况下的体积比为1:1,H为淡黄色粉末,B和G常温下是液体,其余均为气体。根据图中关系推断:
(1)化学式X ;
(2)A的电子式为 ;空间构型 ;
C的结构式为 ;H所包含的化学键类型 。
(3)工业上制取A的化学反应方程式 ;A→D的化学反应方程式 ;
C+H→E的化学反应方程式 ;G→D的离子反应方程式 。
(共14分)下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,X受热分解所得气体在标况下的体积比为1:1,H为淡黄色粉末,B和G常温下是液体,其余均为气体。根据图中关系推断:
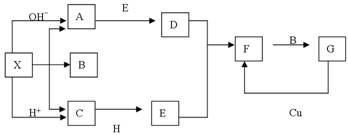
(1)化学式X ;
(2)A的电子式为 ;空间构型 ;
C的结构式为 ;H所包含的化学键类型 。
(3)工业上制取A的化学反应方程式 ;A→D的化学反应方程式 ;
C+H→E的化学反应方程式 ;G→D的离子反应方程式 。
(共14分)下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,X受热分解所得气体在标况下的体积比为1:1,H为淡黄色粉末,B和G常温下是液体,其余均为气体。根据图中关系推断:
(1)化学式X ;
(2)A的电子式为 ;空间构型 ;
C的结构式为 ;H所包含的化学键类型 。
(3)工业上制取A的化学反应方程式 ;A→D的化学反应方程式 ;
C+H→E的化学反应方程式 ;G→D的离子反应方程式 。
(共14分)下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,X受热分解所得气体在标况下的体积比为1:1,H为淡黄色粉末,B和G常温下是液体,其余均为气体。根据图中关系推断:
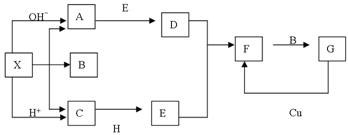
(1)化学式X ;
(2)A的电子式为 ;空间构型 ;
C的结构式为 ;H所包含的化学键类型 。
(3)工业上制取A的化学反应方程式 ;A→D的化学反应方程式 ;
C+H→E的化学反应方程式 ;G→D的离子反应方程式 。
(每空2分,共14分)根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的原子结构示意图为:__________。
(2)写出3p轨道上有2个未成对电子的元素的符号:_____________。
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是_________。
(4)根据VSEPR模型,H3O+的分子立体结构为: ,SO2的立体结构为: 。
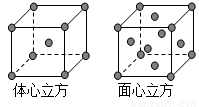
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为 ;若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为 。
1.D 2.C 3.D 4.B 5.B 6.D 7.C 8.C 9.D 10.B
11.B 12.D 13.D 14.C 15.B 16.D 17.A 18.B 19.D 20.B
21(共7分).(1)略 (1分)
极性 (1分) (2) H2O2 H++HO2- (1分)
H2O2+2OH-=O22-+2H2O(1分)
H++HO2- (1分)
H2O2+2OH-=O22-+2H2O(1分)
(3)H2O2+SO2=2H++SO42-(2分)
(4)ABC(1分)
22(共7分).(1)MgO 、C (1分) MgO(1分)
(2)小(1分), 在液态水中,几个水分子间存在氢键,在冰中,水分子大范围地以氢键相互 联结,形成相当疏松的晶体,使体积膨胀,密度减小。(1分)
(3) 4NH3+5O2=4NO+6H2O (1分) 2NH3 + 3CuO 3Cu + 3H2O + N2(2分)
3Cu + 3H2O + N2(2分)
23.(共9分)(1)①两支试管中都产生大量气泡,但盛NaHCO3的试管中反应速率要快得多(1分)
②约为53/42;(1分) ③不正确 (1分)
⑵ ①《NaHCO3、Na2CO3 和盐酸反应过程中热效应的研究》(1分)
②托盘天平(1分)、温度计;(1分)
a吸热(1分) b:放热 (1分) c:NaHCO3溶解和NaHCO3与盐酸反应(1分)
24.(共14分)(1)Fe2O3 (1分) (2)D(1分)
(3)①氢氧化铁胶体,(1分)先产生红褐色沉淀,后沉淀逐渐溶解,溶液变成黄色且有气泡产生(1分)Fe3+ + 3SCN- == Fe(SCN)3 (1分)
Ba2+ + SO42- == BaSO4↓(1分)
②Fe3+与SO32-同时发生氧化还原反应和双水解反应(2分)
③2Fe3+ + 3CO32- + 3H2O == 2Fe(OH)3↓+ 3CO2↑(2分)
④SO32-有较强的还原性,CO32-没有还原性(1分);SO32-水解能力较CO32-小(1分)
(4)4-21mO
 2mFe
(2分)
2mFe
(2分)
25.(共8分)(1)so2(1分)
(2)30(2分)
(3)CaC2+2H2O→Ca(OH)2+C2H2(2分)
(4)N2\CO\C2H4(各1分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com