
题目列表(包括答案和解析)
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s) 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol?L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
| A.2v(NH2)=v(CO2) | B.密闭容器中总压强不变 |
| C.密闭容器中混合气体的密度不变 | D.密闭容器中氨气的体积分数不变 |
 NH4HCO2+NH3?H2O
NH4HCO2+NH3?H2O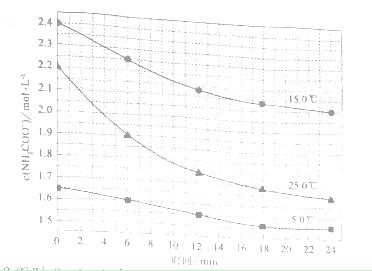
 时,0-6min 氨基甲酸铵水解反应的平抑速率 ______。
时,0-6min 氨基甲酸铵水解反应的平抑速率 ______。 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol?L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
| A.2v(NH2)=v(CO2) | B.密闭容器中总压强不变 |
| C.密闭容器中混合气体的密度不变 | D.密闭容器中氨气的体积分数不变 |
 NH4HCO2+NH3?H2O
NH4HCO2+NH3?H2O
 时,0-6min 氨基甲酸铵水解反应的平抑速率 ______。
时,0-6min 氨基甲酸铵水解反应的平抑速率 ______。在一容积为2L的密闭容器中充入2 mol A(g)、1 mol B(g)发生反应生成C(g),反应过程中各物质的物质的量变化如图所示。下列结论不正确的是( )
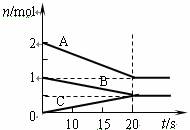
A.该反应的化学方程式为2A+B=C
B.反应进行到20 s时,容器中c(B)=c(C)
C.从反应开始到反应平衡,v(A)=0.05mol?(L?s)-1
D.平衡混合物中,C的体积分数为25%
反应速度V和反应物浓度的关系是用实验方法测定的。化学反应H2+Cl2→2HCl的反应速度V可表示为V=K![]() 式中K为常数,m.n值可用下表中数据确定之。
式中K为常数,m.n值可用下表中数据确定之。
|
|
| V(mol/L?s) |
| 1.0 | 1.0 | 1.0K |
| 2.0 | 1.0 | 2.0K |
| 2.0 | 4.0 | 4.0K |
由此可推得,m.n值正确的是 ( )
A.m=1.n=1 B.m=![]() .n=
.n=![]() C.m=
C.m=![]() .n=1 D.m=1.n=
.n=1 D.m=1.n= ![]()
(14)向体积为2L的固定密闭容器中通入3molX气体,在一定温度下发生如下反应:2X(g)![]() Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y的物质的量浓度变化表示的速率为 mol/L?min。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为:甲v(X)=3. 5mol/L?min; 乙v(Y)=2mol/L?min; 丙v(Z)=4.5mol/L?min; 丁v(X)=0. 075mol/L?s 。若其它条件相同,温度不同,则温度由高到低的顺序是(填序号)
(3)若向达到(1)的平衡体系中充入氩气,则平衡向 (填"左"或"右"或"不移动");若向达到(1)的平衡体系中移走部分混合气体,则平衡向 (填" 左 " 或 " 右 " 或 " 不 移动")。
(4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体,则平衡后X的转化率⑷与⑴的平衡中的X的转化率相比较
A.无法确定 B.⑷一定大于⑴
C.⑷一定等于⑴ D.⑷一定小于⑴
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍与(1)的平衡等效,则a、b、c应该满足的关系为
(6)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍与(1)的平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围应该为
1―5CDBCC 6―10BBABA 11―15CBCDC 16―18ADB
19.(6分)(1)+1(1分) (2)CuI (1分) 0.5(2分)
(3)2、5、2、1(2分)
20.(9分)
|