Ⅰ.在用稀硫酸与锌制取氢气的实验中,加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)加入少量硫酸铜溶液可以加快氢气生成速率的原因是
硫酸铜与Zn反应产生的Cu与Zn及电解质溶液构成原电池,加快反应速率
硫酸铜与Zn反应产生的Cu与Zn及电解质溶液构成原电池,加快反应速率
;
(2)要加快上述实验中气体产生的速率,还可采取的措施有
升高温度、增大锌粒接触面积
升高温度、增大锌粒接触面积
(答两种);
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,某学习小组设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
实 验
混合溶液 |
A |
B |
C |
D |
E |
F |
| 4mol?L-1H2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O/mL |
V7 |
V8 |
V9 |
15 |
10 |
0 |
请完成此实验设计,其中:V
2=
=
V
5=
30
30
,V
6=
10
10
,V
8=
19.5
19.5
;
(第一空填“>”、“<”或“=”;后三空填具体数值)
Ⅱ.常温下,某一元酸HA和NaOH溶液等体积混合,HA和NaOH的浓度以及混合后溶液的pH如下表:
| 组别 |
c(HA)/mol?L-1 |
c(NaOH)/mol?L-1 |
混合液pH |
| 甲 |
c |
0.2 |
pH=7 |
| 乙 |
0.2 |
0.1 |
pH>7 |
| 丙 |
0.1 |
0.1 |
pH=9 |
请回答下列问题:
(4)仅从甲组情况分析,c是否一定等于0.2?
否
否
(选填“是”或“否”).
(5)分析乙组实验数据,HA是
弱
弱
酸(选填“强”或“弱”).该混合液中离子浓度由大到小的顺序是
c(Na+)>c(A-)>c(OH-)>c(H+)
c(Na+)>c(A-)>c(OH-)>c(H+)
.
(6)丙组所得混合液中由水电离出的c(OH
-)=
10-5
10-5
mol?L
-1.

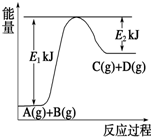 Ⅰ.已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.
Ⅰ.已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.

 存在于煤焦油中,所有原子均处于同一平面内,则1mol E 最多能和
存在于煤焦油中,所有原子均处于同一平面内,则1mol E 最多能和
