
题目列表(包括答案和解析)
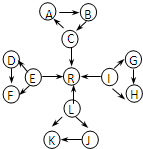 元素及其化合物是中学化学的主干知识,我们在整理元素化合物之间的相互转化时,发现有些物质间存在如图所示的三角转化关系(部分反应物或生成物已略去):
元素及其化合物是中学化学的主干知识,我们在整理元素化合物之间的相互转化时,发现有些物质间存在如图所示的三角转化关系(部分反应物或生成物已略去):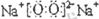
| ||
| ||
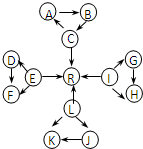 元素及其化合物是中学化学的主干知识,我们在整理元素化合物之间的相互转化时,发现有些物质间存在如图所示的三角转化关系(部分反应物或生成物已略去):
元素及其化合物是中学化学的主干知识,我们在整理元素化合物之间的相互转化时,发现有些物质间存在如图所示的三角转化关系(部分反应物或生成物已略去):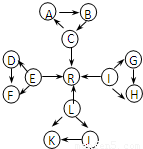

卤族元素的单质和化合物很多,请利用所学物质结构与性质的相关知识回答下列问题:
(1)卤族元素位于周期表的 ????????? 区;氟原子的电子排布图为?????? 溴原子的价电子排布式为????? .
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是??????????
(3)已知高碘酸有两种形式,化学式分别为H5IO6 和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6??????????? HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为???????????? 。
和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6??????????? HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为???????????? 。
(4)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大。这是由于溶液中发生下列反应 I-+ I2 =I3-与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列 ??? 式发生。
A.CsICl2=CsCl+ICl?????? B.CsICl2 =CsI +Cl2
(5)ClO2-的空间构型为?????? 型,中心氯原子的杂化轨道类型为???????? ,写出一个ClO2-的等电子体 ???????????? 。
(6)如图为碘晶体晶胞结构。有关说法中正确的是???? 。

A.碘分子的排列有2种不同的取向
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见图)的密度为ρg/cm3 .NA为阿伏加德罗常数,相邻的两个Ca2+核间距为a cm,则CaF2的摩尔质量可以表示为?????? 。
一、1―5BCBAD 6―10BDACB 11―13DAC
二、14.BC 15.B 16.AC 17.B 18.C 19.C 20.BD 21.B
三、
22.(I)(每空2分,共6分) 左 1.60 9.60(9.6)
(II)(每问4分,共12分)①乙
②A:按乙图连接好实验电路;B:闭合s1、s2,记下电压表的读数U1;C:再断开s2,记下电压表的读数U2 (4分,B项和C项步骤各2分)
③(word).files/image070.gif) (4分)
(4分)
23.(14分)解:(1)设乙在接棒前跑过的路程为s1,
由运动学公式得(word).files/image072.gif) ① (3分)
① (3分)
设乙启动到最大速度过程中,跑过的路程为s,
由运动学公式得(word).files/image074.gif) ② (3分)
② (3分)
由①②得s1=
(2)设甲、乙交棒之前,甲跑过的路程为s2,
有(word).files/image076.gif) ③ (2分)
③ (2分)
在此过程中,对乙分析有(word).files/image078.gif) ④ (2分)
④ (2分)
由②③④得s2=
则甲乙相距△s=s2-s1=
24.(19分)解:(1)对B球:从静止释放至摆到最低点过程中,根据动能定理,有
(word).files/image080.gif) ① (4分)
① (4分)
代入数据,解得B球在最低点的速率 v=
(2) B球与A球碰撞过程中,两球所组成的系统动量守恒,动能不损失,取水平向右为正方向,有(word).files/image082.gif) ② (2分)
② (2分)
(word).files/image084.gif) ③
(2分)
③
(2分)
联立②、③,解得B球速度v1=
A球速度为v2=
根据电荷守恒定律得,碰后A球带电量(word).files/image086.gif) (1分)
(1分)
A球离开平台后,由牛顿第二定律得(word).files/image088.gif) ④ (2分)
④ (2分)
故竖直方向的加速度
(word).files/image090.gif) (1分)
(1分)
A球从离开平台至着地过程中,
由(word).files/image092.gif) 得
得(word).files/image094.gif) (1分)
(1分)
水平位移大小S=v2t=2×
25.(21分)解:(1)设水平拉力为F ,
则(word).files/image096.gif) ① (1分)
① (1分)
对框架由牛顿第二定律得(word).files/image098.gif) ② (2分)
② (2分)
解得(word).files/image100.gif) (1分) ]
(1分) ]
(2)设框架做匀速运动的速度大小为v,
则感应电动势(word).files/image102.gif) ③ (2分)
③ (2分)
回路中的电流 (word).files/image104.gif) ④ (2分)
④ (2分)
对框架由力的平衡得(word).files/image106.gif) ⑤ (2分)
⑤ (2分)
联立上式解得(word).files/image108.gif) (1分)
(1分)
(3)在框架滑过s的过程中,设产生的电热为Q1 ,摩擦生热为Q2
由功能关系得(word).files/image110.gif) ⑥ (3分)
⑥ (3分)
其中(word).files/image112.gif) ⑦ (2分)
⑦ (2分)
在框架匀速运动后,对棒由力的平衡得
(word).files/image114.gif) ⑧ (2分)
⑧ (2分)
另有(word).files/image116.gif) ⑨ (1分)
⑨ (1分)
联立以上各式得(word).files/image118.gif) (2分)
(2分)
|