
题目列表(包括答案和解析)
| |||||||||||||||||||||||||||
硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒;存在于多种生产过程以及自然界中。在人体的很多生理过程中也起着重要作用。
|
资料:① H2S可溶于水(约1:2),其水溶液为二元弱酸。 ② H2S可与许多金属离子反应生成沉淀。 ③ H2S在空气中燃烧,火焰呈淡蓝色。 |
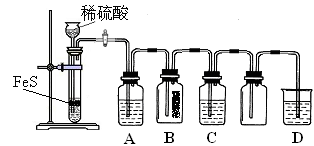
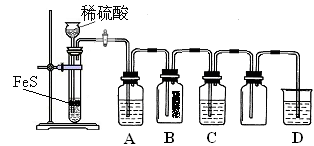
(1)某化学小组设计了制取H2S并验证其性质的实验,如下图所示。A中是CuSO4溶液,B中放有湿润的蓝色石蕊试纸,C中是FeCl3溶液。

回答下列问题:
① A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为_________________。
② B中的现象是_________。
③ C中只有浅黄色沉淀产生,且溶液变浅绿色。则C中发生反应的离子方程式为_____。
④ D中盛放的试剂可以是____________(填标号)。
a. 水 b. 盐酸 c. NaCl溶液 d. NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小组同学又设计了下列实验。
|
|
实验操作 |
实验现象 |
|
实验1 |
将等浓度的Na2S和Na2SO3溶液按体积比2∶1混合 |
无明显现象 |
|
实验2 |
将H2S通入Na2SO3溶液中 |
未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
|
实验3 |
将SO2通入Na2S溶液中 |
有浅黄色沉淀产生 |
已知:电离平衡常数:H2S Ka1 =1.3×10-7;Ka2 = 7.1×10-15
H2SO3 Ka1 =1.7×10-2;Ka2 = 5.6×10-8
① 根据上述实验,可以得出结论:在_________条件下,+4价硫的化合物可以氧化-2价硫的化合物。
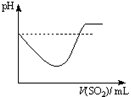
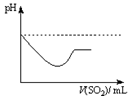
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是______(填序号)。




A B C D
(3)文献记载,常温下H2S可与Ag发生置换反应生成H2。现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应_______。
硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒;存在于多种生产过程以及自然界中。在人体的很多生理过程中也起着重要作用。
| 资料:① H2S可溶于水(约1:2),其水溶液为二元弱酸。 ② H2S可与许多金属离子反应生成沉淀。 ③ H2S在空气中燃烧,火焰呈淡蓝色。 |
| | 实验操作 | 实验现象 |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2∶1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
 |  |  |  |
| A | B | C | D |
| 资料:①H2S可溶于水(约1:2),其水溶液为二元弱酸. ②H2S可与许多金属离子反应生成沉淀. ③H2S在空气中燃烧,火焰呈淡蓝色. |

| 实验操作 | 实验现象 | |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |

| 资料:① H2S可溶于水(约1:2),其水溶液为二元弱酸。 ② H2S可与许多金属离子反应生成沉淀。 ③ H2S在空气中燃烧,火焰呈淡蓝色。 |
| | 实验操作 | 实验现象 |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2∶1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
 |  | 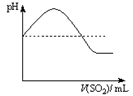 | 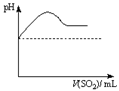 |
| A | B | C | D |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com