
题目列表(包括答案和解析)
(16分)I.将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。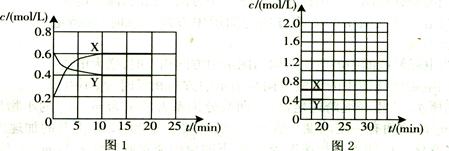
请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是 (填选项字母)。
| A.容器内混合气体的压强不随时间变化而改变 |
| B.容器内混合气体的密度不随时间变化而改变 |
| C.容器内混合气体的颜色不随时间变化而改变 |
| D.容器内混合气体的平均相对分子质量不随时间变化而改变 |
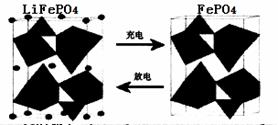
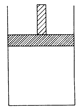
(12分)150 ℃时,向如图所示的容器(密封的隔板可自由滑动,整个过程中保持隔板上部压强不变)中加入4 L N2和H2的混合气体,在催化剂作用下充分反应(催化剂体积忽略不计),反应后恢复到原温度。平衡后容器体积变为3.4 L,容器内气体对相同条件的氢气的相对密度为5。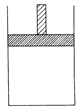
(1)反应前混合气体中V(N2)?:V(H2)=____________;反应达平衡后V(NH3)=____________L;该反应中N2转化率为____________。
(2)向平衡后的容器中充入0.2 mol的NH3,一段时间后反应再次达到平衡,恢复到150 ℃时测得此过程中从外界吸收了6.44 kJ的热量。
①充入NH3时,混合气体的密度将____________,在达到平衡的过程中,混合气体的密度将____________(填“增大”、“减小”或“不变”)。反应重新达平衡的混合气体对氢气的相对密度将____________5(填“>”、“<”或“=”)。
②下列哪些实验现象或数据能说明反应重新到达了平衡____________。
| A.容器不再与外界发生热交换 |
| B.混合气体的平均相对分子质量保持不变 |
| C.当V(N2)?:V(H2):?V(NH3)=1:?3?:2时 |
| D.当容器的体积不再发生变化时 |
| A.容器不再与外界发生热交换 |
| B.混合气体的平均相对分子质量保持不变 |
| C.当V(N2)?:V(H2):?V(NH3)=1:?3?:2时 |
| D.当容器的体积不再发生变化时 |
 向一个容积为2L的恒温容密闭容器中通入2molA,发生如下反应:
向一个容积为2L的恒温容密闭容器中通入2molA,发生如下反应:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com