
题目列表(包括答案和解析)

已知,D是醇类中分子相对质量最小的物质,F是醋酸的同系物;G的分子式为C4H6O2。
试完成下列问题:
(1)指出图中相关反应的反应类型:X____________、Y____________;
(2)写出高分子涂料Ⅰ的结构简式:Ⅰ____________;
(3)写出H的任意三种同分异构体的结构简式:____________、____________和____________(要求物质的类别不同);
(4)完成下列转化的化学方程式:

 如图1为甲烷和O2构成的燃料电池,电解质为KOH溶液,图2为电解
如图1为甲烷和O2构成的燃料电池,电解质为KOH溶液,图2为电解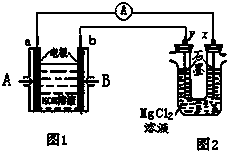 (2010?清远模拟)图中,图1为甲烷和O2构成的燃料电池,图2为电解MgCl2溶液装置.用该装置进行实验,反应开始后,观察到x电极附近出现白色沉淀.下列说法正确的是( )
(2010?清远模拟)图中,图1为甲烷和O2构成的燃料电池,图2为电解MgCl2溶液装置.用该装置进行实验,反应开始后,观察到x电极附近出现白色沉淀.下列说法正确的是( )| 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ |
| FeSO4?7H2O | 15.6 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 | - |
| (NH4)2SO4 | 70.6 | 73.0 | 75.4 | 78.0 | 81.0 | - | 88.0 |
| (NH4)2SO4?FeSO4?6H2O | 12.5 | 17.2 | 21.0 | 28.1 | 33.0 | 40.0 | 44.6 |
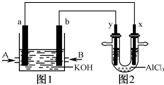 图1为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,图2为电解AlCl3溶液的装置,电极材料均为石墨.用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀.下列说法正确的是( )
图1为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,图2为电解AlCl3溶液的装置,电极材料均为石墨.用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀.下列说法正确的是( )湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com