
题目列表(包括答案和解析)
取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol?L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,试回答下列问题:
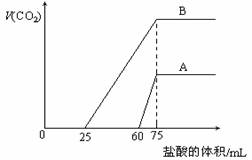
(1)原NaOH溶液的物质的量浓度为 。
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是什么?其物质的量之比为多少?
(3)曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为 mL。
(5分)硫酸和盐酸组成的混合液100 mL,向里面加入氢氧化钡粉末4.275g,充分反应后,经过滤、洗涤、干燥,得到沉淀2.33g,同时测得滤液中的OH-离子浓度为0.100 mol?L-1 。请分别求出原混合液中氯离子,硫酸根离子的物质的量的浓度。(设溶液总体积始终不变)
某同学用10mol?L―1的浓盐酸配制250mL 1 mol?L―1的稀盐酸,并进行有关实验。请回答下列问题:
(1)需要量取浓盐酸 mL。
(2)配制该稀盐酸时使用的仪器量简、烧杯、玻璃棒外,还必须用到的仪器有 、
等。
(3)取所配制的稀盐酸100mL与一定质量的锌充分反应,锌全部溶解后,生成的气体在标准状况下的体积为0.896L,则参加反应的锌的质量为多少克?(写出计算过程)
设反应后溶液的体积仍为100mL,则反应后溶液中H+物质的量浓度是多少?(写出计算过程)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com