
题目列表(包括答案和解析)
四种盐在不同温度下的溶解度(g/100 g水)表
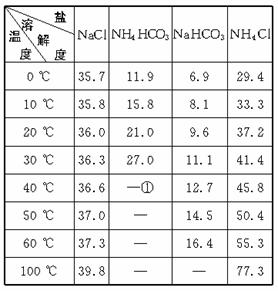
①>35 ℃ NH4HCO3会有分解
请完成下列问题:
(1)反应温度控制在30 ℃—35 ℃,是因为若高于35 ℃,则_______________________,若低于30 ℃,则______________________________________;为控制此温度范围,采取的加热方法为___________________________________。
(2)加料完毕后,继续保温30分钟,目的是________________________________ 。静置后只析出NaHCO3晶体的原因是_____________________________。用蒸馏水洗涤NaHCO3晶体的目的是除去________________________________杂质(以化学式表示)。
(3)过滤所得的母液中含有_______________________(以化学式表示),需加入______________________,并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1—2滴酚酞指示剂,用物质的量浓度为c( mol·L-1)的HCl溶液滴定至溶液由红色到无色(指示![]() +H+====
+H+====![]() 反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:
反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:
w(NaHCO3)= __________________。
测定![]() 浓度很小的碘化物溶液时,可利用“化学放大”反应,其步骤主要是:
浓度很小的碘化物溶液时,可利用“化学放大”反应,其步骤主要是:
①在中性或弱酸性溶液中,用溴将试样中的![]() 完全氧化,生成溴化物和碘酸盐,再煮沸以除去过量的
完全氧化,生成溴化物和碘酸盐,再煮沸以除去过量的![]() 。
。
②将所得溶液冷却到室温.加入足量的KI溶液和稀硫酸,使![]() 氧化
氧化![]() 生成碘单质。再加入
生成碘单质。再加入![]() 萃取生成的
萃取生成的![]() ,设萃取率为100%(后同),再用分液漏斗,把油层分出。
,设萃取率为100%(后同),再用分液漏斗,把油层分出。
③油层用肼(![]() —
—![]() )的水溶液将
)的水溶液将![]() 中的
中的![]() 还原为
还原为![]() ,反应为:
,反应为:
![]()
这时生成的![]() 脱离
脱离![]() 油层,而反萃取至水层。
油层,而反萃取至水层。
④将水层按①法处理。
⑤将④得到的溶液冷却后加入适量KI溶液并用硫酸酸化。
⑥将⑤得到的溶液取一定量用![]() 标准溶液滴定,以求得此时
标准溶液滴定,以求得此时![]() 的浓度,进而求得原溶液中
的浓度,进而求得原溶液中![]() 的浓度。滴定时的反应为:
的浓度。滴定时的反应为:![]()
(1)写出离子方程式:
步骤①____________________________________;
步骤②____________________________________。
(2)根据各步有关反应计算关系,可表明原样品中的![]() 浓度经上述“放大”处理后,可放大到原来的________倍。
浓度经上述“放大”处理后,可放大到原来的________倍。
①在中性或弱酸性溶液中,用溴将试样中的![]() 完全氧化,生成溴化物和碘酸盐,再煮沸以除去过量的
完全氧化,生成溴化物和碘酸盐,再煮沸以除去过量的![]() 。
。
②将所得溶液冷却到室温.加入足量的KI溶液和稀硫酸,使![]() 氧化
氧化![]() 生成碘单质。再加入
生成碘单质。再加入![]() 萃取生成的
萃取生成的![]() ,设萃取率为100%(后同),再用分液漏斗,把油层分出。
,设萃取率为100%(后同),再用分液漏斗,把油层分出。
③油层用肼(![]() —
—![]() )的水溶液将
)的水溶液将![]() 中的
中的![]() 还原为
还原为![]() ,反应为:
,反应为:
![]()
这时生成的![]() 脱离
脱离![]() 油层,而反萃取至水层。
油层,而反萃取至水层。
④将水层按①法处理。
⑤将④得到的溶液冷却后加入适量KI溶液并用硫酸酸化。
⑥将⑤得到的溶液取一定量用![]() 标准溶液滴定,以求得此时
标准溶液滴定,以求得此时![]() 的浓度,进而求得原溶液中
的浓度,进而求得原溶液中![]() 的浓度。滴定时的反应为:
的浓度。滴定时的反应为:![]()
(1)写出离子方程式:
步骤①____________________________________;
步骤②____________________________________。
(2)根据各步有关反应计算关系,可表明原样品中的![]() 浓度经上述“放大”处理后,可放大到原来的________倍。
浓度经上述“放大”处理后,可放大到原来的________倍。
 乙酸乙酯的实验室和工业制法常采用如下反应:
乙酸乙酯的实验室和工业制法常采用如下反应:
| ||
| △ |
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.5 | 78.5 | 117.9 | 77 |
| 同一反应时间 | 同一反应应温度 | ||||
| 反应温度/℃ | 转化率(%) | 选择性(%)* | 反应时间/h | 转化率(%) | 选择性(%)* |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| *选择性100%表示反应生成的产物全部是乙酸乙酯和水 | |||||
 CH3COOC2H5 + H2O
CH3COOC2H5 + H2O 


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com