
题目列表(包括答案和解析)

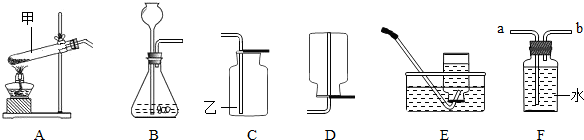
| 加热 |
| 加热 |
| 二氧化锰 |
| 二氧化锰 |
| 实验步骤 | 实验现象 | 实验结论 | |
实验一 |
将带火星的木条伸入盛有过氧化氢的试管中 将带火星的木条伸入盛有过氧化氢的试管中 |
木条不复燃 | 常温下过氧化氢溶液不分解 |
实验二 |
在装有过氧化氢的试管中加入水泥块,然后将带火星的木条伸进试管中. | 木条复燃 |
加入水泥块能加快过氧化氢的分解速率 加入水泥块能加快过氧化氢的分解速率 |
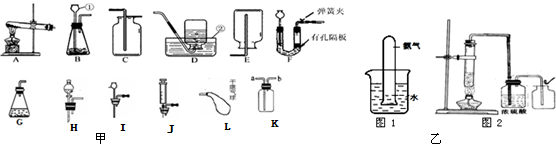
| ||
| ||
| ||
| ||
注意事项:
1. 答出其他合理答案,请参照评分标准给分。
2. 没有特别要求写化学式的,写化学式和名称均得分。
一、选择题(每小题1分,共12分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
C
A
C
D
B
D
A
A
A
B
B
A
二、填空题(每空1分,共16分)
13.(1)CH4 (2) Na2CO3 (3)Ca(OH)2
14.(1)A (2)b 升高温度或增加溶剂
15.N2或CO2(其他合理答案也行) 除去氧气和水蒸气 铁锈 除水
16.(1)A (2)C (3) C
17.(1)不能 没有沉淀、气体或水生成(或不符合复分解反应发生的条件)
(2)Na2SO4+Ba(OH)2=BaSO4↓+2NaOH等答案合理均可
三、简答题(共12分)
18.⑴ 除铁锈 ⑵ 盐酸(或稀硫酸) Fe2O3+6HCl===2FeCl3+3H2O (或Fe2O3+3H2SO4==Fe2SO4+3H2O) ⑶ 涂上除锈漆
19.(1)置换;反应前后元素的化合价有变化(只要表示“化合价有变化”的意思就可以给分,如写“有变化”或写“氧化还原反应”都可得分)
(2)Zn、Cu、Ag(或锌、铜、银);Cl2、Br2、I2(或氯气、溴、碘也给分)
20.沙里淘金:利用黄金的物理性质(很大密度、不溶于水、金属光泽)进行工作。这个过程属于物理变化过程。这也和黄金稳定的化学性质有关或它在自然界以单质形式存在。
点石成金:
要点一:如果石头中原来含有金元素,经过“点化”是可以变成金子的。
要点二:如果石头中没有金元素,用化学方法“点化”是不可能得到金子的,因为化学变化过程中元素种类不变。
要点三:如果这里的金不只是指狭义的“黄金”而是指的金属,那么,有些石头(金属矿物)是能够经化学方法冶炼(点化)成金属单质的,这个过程属于化学变化。(上述3个要点只要答对其一就可得分)
四.综合应用题(共10分)
21.①Cu(OH)2+2HCl=CuCl2+2H2O 等
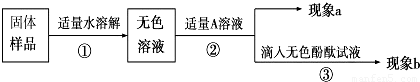
② 不行 碳酸钠的水溶液也呈碱性,酚酞仍然是红色 HCl Ca(OH)2等
③ 47%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com