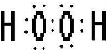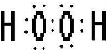(2012?山东模拟)已知A、B、C、D、E是化学中常见的物质,其中E是一种无色无味的液体,它们之间有如下反应关系.

(1)若A是一种黑色单质,B是一种常见的难挥发性酸,C、D都是气体,试写出此反应的化学方程式
C+2H
2SO
4(浓)
CO
2↑+2SO
2↑+2H
2O
C+2H
2SO
4(浓)
CO
2↑+2SO
2↑+2H
2O
.以下试剂中可用来区别C、D两种气体的是
①②④
①②④
.
①酸性高锰酸钾溶液 ②溴水 ③澄清石灰水 ④品红溶液
(2)若A是一种黑色氧化物,B是一种常见的挥发性酸,反应时生成的C是气体,反应的离子方程式是
MnO
2+4H
++2Cl
-Mn
2++Cl
2↑+2H
2O
MnO
2+4H
++2Cl
-Mn
2++Cl
2↑+2H
2O
当生成1molC时转移电子数是
2NA
2NA
.
(3)若A是一种双原子分子,B是一种乳状物,得到的C、D混合物化学式分别是
CaCl2、Ca(ClO)2
CaCl2、Ca(ClO)2
.
(4)若aA(g)+bB(g)?cC(g)+dD(s)+eE(g)反应中A%随温度和压强的改变如下.

下列判断正确的是
②③
②③
.
①a+b<c+d+e ②正反应是吸热反应
③加入物质D对平衡没有影响 ④增大加强时平衡左移,平衡常数减小.

 它的空间利用率为
它的空间利用率为