(1)在其他条件不变的情况下,研究改变起始氢气物质的量[用n(H
2)表示]对N
2(g)+3H
2(g)?2NH
3(g)反应的影响,实验结果可表示成如图1所示的规律(图中T表示温度,n表示物质的量):
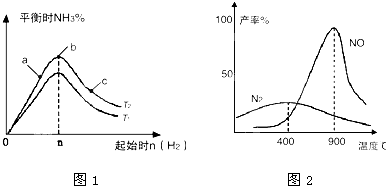
①比较在a、b、c三点所处的平衡状态中,反应物N
2的转化率最高的是
c
c
.
②若容器容积为1L,n=3mol,反应达到平衡时N
2、H
2的转化率均为60%,则在起始时体系中加入N
2的物质的量为
1
1
mol,此条件下(T
2),反应的平衡常数K=
2.08(mol/L)-2
2.08(mol/L)-2
,当温度升高时该平衡常数将
减小
减小
.
③图象中T
2和T
1的关系是
低于
低于
.(填“高于”、“低于”、“等于”、“无法确定”).
(2)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图2):
4NH
3+5O
2?4NO+6H
2O,4NH
3+3O
2?2N
2+6H
2O
温度较低时以生成
N2
N2
为主,温度高于900℃时,NO产率下降的原因是
氨气氧化生成NO的反应是放热反应,升高温度转化率下降
氨气氧化生成NO的反应是放热反应,升高温度转化率下降
.

