
题目列表(包括答案和解析)
| 实验方案(I) | 实验现象(Ⅱ) | 答案(III) | |
| 实验方案I | 实验现象II | ||
| 1.用砂纸擦后的镁带与沸 水反应,再向反应液中滴 加酚酞 |
A浮与水面,剧烈反应,放出气体, 熔成-个小球,在水面上无定向移 动,随之消失,溶液变红色. |
1 | |
| 2.向新制的H2S饱和溶 液中滴加新制的氯水 |
B.产生大量气体,可在空气中燃 烧,溶液变成浅红色 |
2 | |
| 3.钠与滴有酚酞的冷水反应 | C.反应不十分剧烈,产生的气体 可以在空气中燃烧 |
3 | |
| 4.镁带与2mol/L的盐酸 反应 |
D.剧烈反应,产生的气体可以在 空气中燃烧 |
4 | |
| 5铝条与2mol/L的盐酸 反应 |
E.生成白色絮状沉淀,继而沉淀 消失 |
5 | |
| 6.向AlCl2溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 | 6 | |
决定微粒半径大小的主要因素:___________、___________和___________。
(1)同种元素的微粒半径比较:核外电子数越多,半径越大。
①阳离子半径___________相应原子半径:如r(Na+)<r(Na)。
②阴离子半径___________相应原子半径:如r(Cl-)>r(Cl)。
③同种元素不同价态的离子,价态越高,离子半径___________:如r(Fe2+)>r(Fe3+)。
(2)不同种元素的微粒半径比较:
①具有相同的电子层数而原子序数不同的原子,原子序数越大,半径___________(稀有气体元素除外)。如:r(Na) ___________r(Mg) ___________r(Al)___________r(S) ___________r(Cl)。
②最外层电子数相同而电子层数不同的原子(限主族),电子层数越多,原子半径___________;其同价态的离子半径也如此。
如:r(F)_________r(Cl) _________r(Br) _________r(I);r(F-)_________r(Cl-) ________r(Br-) ___________r(I-)。
③电子层结构相同的不同粒子,核电荷数越大,半径___________。
如:r(S2-)___________r(Cl-)___________r(K+)___________r(Ca2+)。
1932年美国化学家鲍林(L.Pauling)首先提出了电负性的概念。下表给出的是第三周期的七种元素和第四周期的钾元素的电负性的值。下列说法不正确的是( )
|
元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
|
电负性 |
0.9 |
1.2 |
1.5 |
? |
2.1 |
2.3 |
3.0 |
0.8 |
A 钙元素的电负性的取值范围在0.8与1.2之间
B. 硫化钠的电子式为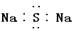
C 硅元素的电负性的取值范围 在1.5与2.1之间
D Al与S形成的化学键可能为共价键
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
|
⑨ |
⑦ |
⑧ |
|
根据元素在周期表中的位置可知,①~⑨分别是H、C、N、O、Na、Al、S、Cl、P。
Ⅰ、(1)元素⑦中质子数和中子数相等的原子符号是________________。
(2)④、⑤两种元素原子按1:1组成的常见化合物的化学式________________。
(3)③、⑧和⑨的最高价氧化物对应水化物的酸性由强到弱的顺序是________________。
(4)用电子式表示①和⑤形成化合物的过程_________________________。
Ⅱ、由表中元素形成的物质A、B、C可发生以下反应(副产物已略去),试回答:

(1)若X是强氧化性单质,则A不可能是______________
a、S b、N2 c、Na d、Mg e、Al
(2)若X是一种常见过渡金属单质,向C的水溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,检验此C溶液中金属离子的方法是____________________________________
__________________________;又知在酸性溶液中该金属离子能被双氧水氧化,写出该反应的离子方程式:___________________________________________。
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | | ⑨ | ⑦ | ⑧ | |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com