
题目列表(包括答案和解析)
利用铝热反应焊接钢轨的原理是2Al+Fe2O3![]() 2Fe+ Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褪褐色硬块的组成。
2Fe+ Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褪褐色硬块的组成。
样品处理:将褐色硬块处理成粉末状。
(1)研究小组首先取少量粉末加入 溶液中,发现粉末部分溶解,但没有气泡产生,实验结论是:粉末中含有Al2O3而没有Al。
(2)根据以述实验判断该褐色硬块的组成基本确定为Fe、Fe2O3、Al2O3。
提出假设:
假设1:固体粉末中除Al2O3外还有Fe;
假设2:固体粉末中除Al2O3外还有 ;
假设3:固体粉末中除Al2O3外还有Fe和Fe2O3。
实验实施:
(3)请以上述粉末为样品,验证其组成。限选实验仪器与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、过滤器;20%KSCN、3mol/LNaOH、3mol/LHCl、3mol/LHNO3、3mol/LCuSO4、0.01mol/LKMnO4、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。
| 实验操作 | 预期现象和结论 |
|
| |
| 步骤2:将步骤1的滤渣转移到烧杯B中,加入足量 ,充分搅拌,过滤,洗涤。 | 有红色固体生成,说明粉末中含有
。 |
| 步骤3:将步骤2的滤渣转移到烧杯C中,
。 |
, 说明粉末中含有Fe2O3。 |
某溶液中含有K+、NH+4、Al3+、OH-、AlO-2、SO2-4、CO2-3、SiO2-3、Cl-等离子中的某几种。现进行如下实验:①取少量溶液逐滴加入盐酸,先无明显现象,当盐酸加到一定体积后开始产生沉淀并逐渐增多,在沉浣不再增加后又产生一种无色气体,在气体不再产生后沉淀开始溶解,直至最后完全消失;
②取①所得溶液,加入Ba(OH)2溶液,无明显现象。
(1)原溶液中肯定存在的离子是 ;肯定不存在的离子是 。
(2)已知用一定体积的原溶液进行实验①时,需消耗0.2 mol/L的盐酸5 mL,这时向所得溶液中加入足量的硝酸银溶液可得沉淀0.187g,则原溶液中 (填“有”“没有”或“不确定”)Cl-。
孔雀石主要含Cu2(OH)2CO3,还含少量杂质FeO、Fe2O3、SiO2。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
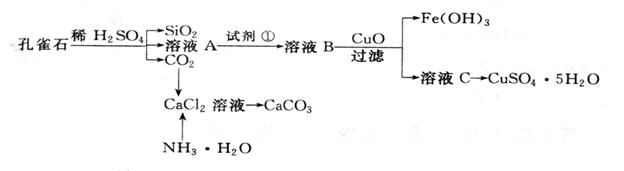
请回答下列问题:
(1)溶液A的金属离子有__________。检验溶液A中Fe3+的最佳试剂为
A、KMnO4 B、(NH4) 2S C、H2O2 D、KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、 、过滤等操作。
(3)制备CaCO3时,应向CaCl2溶液中先加入NH3.H2O,然后通入CO2,反应的方程式:__________________________________________________________________。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,用KMnO4标准溶液滴定时应选用 滴定管(填“酸式”或“碱式”)。
(5)探究氧化铜的性质:取A、B两支试管,往A中加入适量的CuO粉末,再分别向A和B加入等体积3% H2O2溶液,只观察到A中有大量气泡,结论是: 。
| A、2×10-10m | B、5×10-10m | C、2×10-9m | D、5×10-9m |
 (2008?阳江一模)用油膜法测分子大小的实验.
(2008?阳江一模)用油膜法测分子大小的实验.一、选择题
1.D 2.B 3.C 4.C 5.D
26.(25分)
Ⅰ.(1)水淹时间 (2分)
(2)海 互花米草采样地点 (各2分,共4分)
(3)3 0 (各3分,共6分)
(4)长期水淹互花米草无氧呼吸造成供能不足、酒精中毒 (3分 , 答无氧呼吸得1分,供能不足得1分,酒精中毒得1分)
Ⅱ.(1)下丘脑 体液 ④⑤ (各2分,共6分)
(2)①②③ (3分,没按顺序写及不完整不得分)
汗液分泌减少或毛细血管收缩 (2分,任写一点均可得分)
27.(15分)
(1)大翅 (3分)
(2)分离 (3分)
F2发生性状分离,且分离比为3:1(3分,答性状分离得1分,答3:1再得2分)
(3)X (3分)
|