
题目列表(包括答案和解析)
| 温度/℃ | 10 | 20 | 30 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 |
| FeSO4?7H2O | 20.0 | 26.5 | 32.9 |
| (NH4)2SO4?FeSO4 | 17.2 | 21.6 | 28.1 |
| 温度/℃ | 10 | 20 | 30 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 |
| FeSO4?7H2O | 20.0 | 26.5 | 32.9 |
| (NH4)2SO4?FeSO4 | 17.2 | 21.6 | 28.1 |
| 温度/℃ | 10 | 20 | 30 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 |
| FeSO4?7H2O | 20.0 | 26.5 | 32.9 |
| (NH4)2SO4?FeSO4 | 17.2 | 21.6 | 28.1 |
| 温度/℃ | 10 | 20 | 30 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 |
| FeSO4?7H2O | 20.0 | 26.5 | 32.9 |
| (NH4)2SO4?FeSO4 | 17.2 | 21.6 | 28.1 |

| 1 |
| V |
| 1 |
| V |
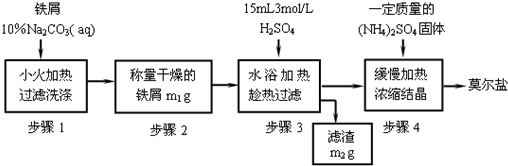
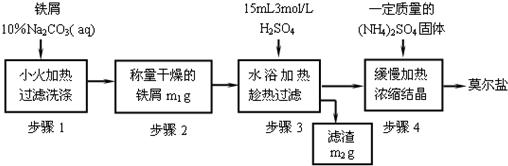
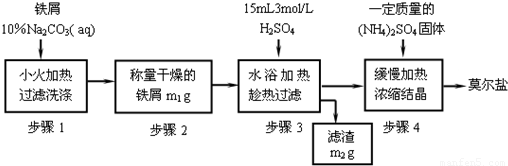
莫尔盐【硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O】是一种重要化学试剂,实验室用含油污的铁片来制取莫尔盐,流程如下:
请回答下列问题:
(1)加入10%Na2CO3溶液的原因是___________________(用离子方程式表示)。
(2)A物质可以为________(填编号)。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
(3)B物质的成分为_________________。
(4) 加少量硫酸调节pH为 1~2的目的是_____________________________,
操作Ⅱ的名称_______________________________________________。
(5)用无水乙醇洗涤潮湿的硫酸亚铁铵晶体是为了除去晶体表面残留的水分,不用加热烘干的原因是_________________________________________。
(6)鉴定所得晶体中含有Fe2+、NH 、SO
、SO 离子的实验方法正确的是________(填编号)。
离子的实验方法正确的是________(填编号)。
a.取少量样品于试管,加水溶解,通入适量Cl2,再加KSCN溶液,观察现象
b.取少量样品于试管,加水溶解,加入酸性KMnO4溶液,观察现象
c.取少量样品于试管,加水溶解,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,观察试纸颜色的变化
d.取少量样品于试管,加水溶解,加入盐酸后再加入BaCl2溶液,观察现象
一、二、选择题
题号
1
2
3
4
5
6
7
8
答案
B
C
C
D
D
C
B
C
题号
9
10
11
12
13
14
答案
B
BD
D
AC
D
AB
三、(本题包括1小题,共10分)
15、⑴ 除去铁屑表面的油污;⑵减少FeSO4的损失;⑶防止失去结晶水以及Fe2+、NH4+的水解;⑷ 在相同温度下,(NH4)2SO4?FeSO4?6H2O的溶解度比(NH4)2SO4、FeSO4小
 g(每空2分)
g(每空2分)
四、(本题包括2小题,共18分)
16、⑴②Na2WO4+2HCl==H2WO4+2NaCl ;③::H2WO4==WO3+H2O (每空2分)
⑵WO3+
⑶如果用碳作还原剂,混杂在金属中的碳不易除去,而且碳在高温下和金属钨也能生成碳化钨,不容易获得纯净的金属钨。H2作还原剂,过量的H2会从体系中自动逸出。
17、⑴X (1分); b和d(2分);⑵①0.04(1分); ②Kb=10/
五、(本题包括1小题,共12分)
18、⑴加成反应 ⑵⑥ 保护B(或G)分子中的C=C不被氧化
 |
⑶
⑷ HOOCCH2CHClCOOH+3NaOH NaOOCCH=CHCOONa+NaCl+3H2O
NaOOCCH=CHCOONa+NaCl+3H2O
2CH3CH2CH2CH2OH+HOOCCH=CHCOOH
CH3(CH2)3OOCCH=CHCOO(CH2)3CH3+2H2O (每空2分,共12分)
六、(本题包括1小题,共10分)
 ⑴减缓臭氧空洞的增大(1分);⑵4NOx+(5-2x)O2+2H2O=4HNO3(2分);
⑴减缓臭氧空洞的增大(1分);⑵4NOx+(5-2x)O2+2H2O=4HNO3(2分);
⑶NOx(或氮氧化物)(1分) 2NOx+2xCO N2+2xCO2(2分)
2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1);△H=-1452kJ/mol(2分)⑷1.62×10-2(2分)
七、(本题包括1小题,共10分)
⑴Pb2O3+6HCl(浓)=2PbCl2+Cl2↑+3H2O(2分)
⑵根据题意:分解所得混合物中n(Pb2+)= ax mol、n(Pb4+)= a (1-x) mol
根据电子守恒:n(O2)= ax/2 mol、n(Cl2)=a (1-x) mol (2分)
y=n(O2)+n(Cl2)=ax/2 mol+a (1-x) mol=a (1-x/2) mol(2分)
⑶ Pb3O4、PbO 3:4(4分)
提示:当分解产物为Pb2O3时,x=1/2;
当分解产物为Pb3O4时,x=2/3;
当分解产物为PbO时,x=1。
根据题意有:n(O2)/ n(Cl2)=5:3,即x=10/13
所以此时剩余固体包括Pb3O4、PbO两种物质,其物质的量之比为3:4。
注:答题中出现的其它合理答案均给分。
八、(本题包括1小题,共12分)
A【物质结构与性质】
⑴[Ar]3d74s2;⑵N>O>C;⑶2:1;⑷sp2、sp3;将粗产品加入到热水中,趁热过滤,带滤液冷却有大量晶体析出时再过滤;⑸⑤③④①②(每空2分)
B【实验化学】
⑴蒸馏、过滤
⑵ 
⑶使碳酸锰沉淀完全; ⑷反应过程中有副反应产生,或苯甲醛可能被氧化成苯甲酸,或该反应有一定的限度。⑸绿色化学(每空2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com