
题目列表(包括答案和解析)
下列叙述中正确的是( )
A.HClO4、H2SO4、H3PO4的酸性由强到弱 B.HF、HCl、HBr、Hl的稳定性依次增强
C.金属的熔点和沸点都很高 D.H2O是一种非常稳定的化合物,这是由于氢键所致
【解析】非金属性越强,相应最高价氧化物对应水化物的酸性就越强,氢化物的稳定性越强,所以A正确,B错误。金属的熔沸点差别很大,有的很高,例如金属钨,有的很低,例如金属汞,碱金属等,C不正确。水是由极性键形成的共价化合物,其稳定是由于共价键的缘故,氢键影响的是水的沸点,D错误。答案选A。
下列叙述中正确的是( )
A.HClO4、H2SO4、H3PO4的酸性由强到弱 B.HF、HCl、HBr、Hl的稳定性依次增强
C.金属的熔点和沸点都很高 D.H2O是一种非常稳定的化合物,这是由于氢键所致
【解析】非金属性越强,相应最高价氧化物对应水化物的酸性就越强,氢化物的稳定性越强,所以A正确,B错误。金属的熔沸点差别很大,有的很高,例如金属钨,有的很低,例如金属汞,碱金属等,C不正确。水是由极性键形成的共价化合物,其稳定是由于共价键的缘故,氢键影响的是水的沸点,D错误。答案选A。

(1)从表中可以看出,除H外,其余非金属元素原子_________(填序号)
a.最外层电子数都大于4 b.最外层电子数都大于电子层数
(2)以下方法可以比较S、Cl非金属性强弱的是_________(填序号,答案可能不止一个)
a.分别测定Na2S溶液和NaCl溶液的pH
b.将Fe分别与S、Cl2反应,分析产物中Fe的化合价
c.将H2S通入氯水中,观察到有淡黄色固体析出:H2S + Cl2 → 2HCl + S↓
(3)以下关于元素的用途中叙述正确的是__________(填序号,答案可能不止一个)
a.P、S、Cl等元素的化合物常用来制取农药 b.Si、Ge可用于制半导体材料
c.钨是熔点最高的金属,可与钠制成合金
(4)近期,有科学家宣布,他们通过分析182 72Hf和182 74W的相对含量,发现月球的产生起码比地球早700万年。这里的“182”是指原子的_____________(填序号)。
a.质子数 b.中子数 c.质量数 d.相对原子质量
(5)美俄科学家2006年10月5日宣布他们制得了118号元素。试分析,若制得117号元素(位置见表),按元素周期表中金属与非金属的分区,它应是一种________(选填“金属”、“非金属”)元素,写出117号元素最外层电子排布式___________。
一、二、选择题
题号
1
2
3
4
5
6
7
8
答案
B
C
C
D
D
C
B
C
题号
9
10
11
12
13
14
答案
B
BD
D
AC
D
AB
三、(本题包括1小题,共10分)
15、⑴ 除去铁屑表面的油污;⑵减少FeSO4的损失;⑶防止失去结晶水以及Fe2+、NH4+的水解;⑷ 在相同温度下,(NH4)2SO4?FeSO4?6H2O的溶解度比(NH4)2SO4、FeSO4小
 g(每空2分)
g(每空2分)
四、(本题包括2小题,共18分)
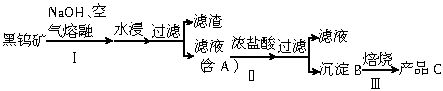
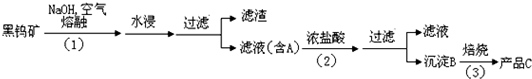
16、⑴②Na2WO4+2HCl==H2WO4+2NaCl ;③::H2WO4==WO3+H2O (每空2分)
⑵WO3+
⑶如果用碳作还原剂,混杂在金属中的碳不易除去,而且碳在高温下和金属钨也能生成碳化钨,不容易获得纯净的金属钨。H2作还原剂,过量的H2会从体系中自动逸出。
17、⑴X (1分); b和d(2分);⑵①0.04(1分); ②Kb=10/
五、(本题包括1小题,共12分)
18、⑴加成反应 ⑵⑥ 保护B(或G)分子中的C=C不被氧化
 |
⑶
⑷ HOOCCH2CHClCOOH+3NaOH NaOOCCH=CHCOONa+NaCl+3H2O
NaOOCCH=CHCOONa+NaCl+3H2O
2CH3CH2CH2CH2OH+HOOCCH=CHCOOH
CH3(CH2)3OOCCH=CHCOO(CH2)3CH3+2H2O (每空2分,共12分)
六、(本题包括1小题,共10分)
 ⑴减缓臭氧空洞的增大(1分);⑵4NOx+(5-2x)O2+2H2O=4HNO3(2分);
⑴减缓臭氧空洞的增大(1分);⑵4NOx+(5-2x)O2+2H2O=4HNO3(2分);
⑶NOx(或氮氧化物)(1分) 2NOx+2xCO N2+2xCO2(2分)
2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1);△H=-1452kJ/mol(2分)⑷1.62×10-2(2分)
七、(本题包括1小题,共10分)
⑴Pb2O3+6HCl(浓)=2PbCl2+Cl2↑+3H2O(2分)
⑵根据题意:分解所得混合物中n(Pb2+)= ax mol、n(Pb4+)= a (1-x) mol
根据电子守恒:n(O2)= ax/2 mol、n(Cl2)=a (1-x) mol (2分)
y=n(O2)+n(Cl2)=ax/2 mol+a (1-x) mol=a (1-x/2) mol(2分)
⑶ Pb3O4、PbO 3:4(4分)
提示:当分解产物为Pb2O3时,x=1/2;
当分解产物为Pb3O4时,x=2/3;
当分解产物为PbO时,x=1。
根据题意有:n(O2)/ n(Cl2)=5:3,即x=10/13
所以此时剩余固体包括Pb3O4、PbO两种物质,其物质的量之比为3:4。
注:答题中出现的其它合理答案均给分。
八、(本题包括1小题,共12分)
A【物质结构与性质】
⑴[Ar]3d74s2;⑵N>O>C;⑶2:1;⑷sp2、sp3;将粗产品加入到热水中,趁热过滤,带滤液冷却有大量晶体析出时再过滤;⑸⑤③④①②(每空2分)
B【实验化学】
⑴蒸馏、过滤
⑵ 
⑶使碳酸锰沉淀完全; ⑷反应过程中有副反应产生,或苯甲醛可能被氧化成苯甲酸,或该反应有一定的限度。⑸绿色化学(每空2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com