
题目列表(包括答案和解析)
 试回答下列问题:
试回答下列问题:
| 物 质 | 开始沉淀时的pH | 完全沉淀时的pH |
| 氢氧化铁 | 2.7 | 3.7 |
| 氢氧化亚铁 | 7.6 | 9.6 |
| 氢氧化铜 | 5.2 | 6.4 |
试回答下列问题:(1)下列实验中所选用的仪器或操作以及结论不合理的是
A.用托盘天平称量11.7g氯化钠晶体
B.用碱式滴定管量取20.00mL Na2CO3溶液
C.加热NH4Cl晶体时,用湿润红色石蕊试纸靠近试管口,检验NH3的生成
D.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上与标准比色卡比较
E.仅用蒸馏水和pH试纸,就可以鉴别pH相等的H2SO4和CH3COOH溶液
(2)海洋植物海带中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下图:
I.指出提取碘的过程中有关的实验操作名称:① ,③
II.提取碘的过程中,可供选择的有机试剂是 (填序号)
A.甲苯、酒精 B.四氯化碳、苯
C.汽油、乙酸 D.汽油、甘油
III.为使碘水溶液转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有
(7分)试回答下列问题:
(1)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为 。
(2)把1 molNa和1molMg分别投入到过量的盐酸中,分别得到溶液a和b,则溶液a和b的质量关系为![]()
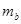
(3)右图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答
下列问题:
①该浓盐酸中HCl的物质的量浓度为 mol/L。
②标准状况下,1.00L水(密度:1.00g·cm-3)吸收 L的HCl可制得上述浓盐酸。
一、二、选择题
题号
1
2
3
4
5
6
7
8
答案
B
C
C
D
D
C
B
C
题号
9
10
11
12
13
14
答案
B
BD
D
AC
D
AB
三、(本题包括1小题,共10分)
15、⑴ 除去铁屑表面的油污;⑵减少FeSO4的损失;⑶防止失去结晶水以及Fe2+、NH4+的水解;⑷ 在相同温度下,(NH4)2SO4?FeSO4?6H2O的溶解度比(NH4)2SO4、FeSO4小
 g(每空2分)
g(每空2分)
四、(本题包括2小题,共18分)
16、⑴②Na2WO4+2HCl==H2WO4+2NaCl ;③::H2WO4==WO3+H2O (每空2分)
⑵WO3+
⑶如果用碳作还原剂,混杂在金属中的碳不易除去,而且碳在高温下和金属钨也能生成碳化钨,不容易获得纯净的金属钨。H2作还原剂,过量的H2会从体系中自动逸出。
17、⑴X (1分); b和d(2分);⑵①0.04(1分); ②Kb=10/
五、(本题包括1小题,共12分)
18、⑴加成反应 ⑵⑥ 保护B(或G)分子中的C=C不被氧化
 |
⑶
⑷ HOOCCH2CHClCOOH+3NaOH NaOOCCH=CHCOONa+NaCl+3H2O
NaOOCCH=CHCOONa+NaCl+3H2O
2CH3CH2CH2CH2OH+HOOCCH=CHCOOH
CH3(CH2)3OOCCH=CHCOO(CH2)3CH3+2H2O (每空2分,共12分)
六、(本题包括1小题,共10分)
 ⑴减缓臭氧空洞的增大(1分);⑵4NOx+(5-2x)O2+2H2O=4HNO3(2分);
⑴减缓臭氧空洞的增大(1分);⑵4NOx+(5-2x)O2+2H2O=4HNO3(2分);
⑶NOx(或氮氧化物)(1分) 2NOx+2xCO N2+2xCO2(2分)
2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1);△H=-1452kJ/mol(2分)⑷1.62×10-2(2分)
七、(本题包括1小题,共10分)
⑴Pb2O3+6HCl(浓)=2PbCl2+Cl2↑+3H2O(2分)
⑵根据题意:分解所得混合物中n(Pb2+)= ax mol、n(Pb4+)= a (1-x) mol
根据电子守恒:n(O2)= ax/2 mol、n(Cl2)=a (1-x) mol (2分)
y=n(O2)+n(Cl2)=ax/2 mol+a (1-x) mol=a (1-x/2) mol(2分)
⑶ Pb3O4、PbO 3:4(4分)
提示:当分解产物为Pb2O3时,x=1/2;
当分解产物为Pb3O4时,x=2/3;
当分解产物为PbO时,x=1。
根据题意有:n(O2)/ n(Cl2)=5:3,即x=10/13
所以此时剩余固体包括Pb3O4、PbO两种物质,其物质的量之比为3:4。
注:答题中出现的其它合理答案均给分。
八、(本题包括1小题,共12分)
A【物质结构与性质】
⑴[Ar]3d74s2;⑵N>O>C;⑶2:1;⑷sp2、sp3;将粗产品加入到热水中,趁热过滤,带滤液冷却有大量晶体析出时再过滤;⑸⑤③④①②(每空2分)
B【实验化学】
⑴蒸馏、过滤
⑵ 
⑶使碳酸锰沉淀完全; ⑷反应过程中有副反应产生,或苯甲醛可能被氧化成苯甲酸,或该反应有一定的限度。⑸绿色化学(每空2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com