
题目列表(包括答案和解析)
| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
超音速飞机在平流层飞行时,尾气中的![]() 会破坏臭氧层。科学家正在研究利用催化技术将尾气中的
会破坏臭氧层。科学家正在研究利用催化技术将尾气中的![]() 和
和![]() 转变成
转变成![]() 和
和![]() ,化学方程式如下:
,化学方程式如下:
2NO+2CO![]() 2CO2 + N2 ;为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2 + N2 ;为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
 请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的![]() 0(填写“>”、“<”、“=”。
0(填写“>”、“<”、“=”。
(2)前2s内的平均反应速率v(N2)=_____________。
(3)在该温度下,反应的平衡常数K= 。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 | T/OC | NO初始浓度/mol·L-1 | CO初始浓度/mol·L-1 | 催化剂的比表面积/m2·g-1 |
| I | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| II | 124 | |||
| III | 350 | 124 |
①请在上表格中填入剩余的实验条件数据。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号。
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO![]() 2CO2+N2。
2CO2+N2。
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)= 。
(3)在该温度下,反应的平衡常数K= 。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
①请在上表空格中填入剩余的实验条件数据。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号。
![]()
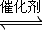 2CO2(g)+N2(g).
2CO2(g)+N2(g).| 时间(s) | 1 | 2 | 3 | 4 | 5 | |
| c(NO) (mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) (mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
|
下列说法正确的是 | |
| [ ] | |
A. |
标准状况下,11.2 L臭氧中含氧原子数为6.02×1023 |
B. |
15 g乙烷所含极性共价键的数目为3×6.02×1023 |
C. |
常温下,100 mL 0.1 mol/L醋酸溶液中含醋酸分子为0.01×6.02×1023 |
D. |
一定条件下,2 mol二氧化硫和1 mol氧气混合,反应时转移的电子数为4×6.02×1023 |
一、选择题(30分)
1.C 2.A 3.D 4.B 5.B
二、非选择题(42分)
30.(共22分)
Ⅰ.(12分)
(1)N是光合酶、ATP、NADP+、叶绿素(叶绿体膜成分)等的组成成分(答案合理即可给分) 倒伏
(2)①a、b ②NH3、CO2 (缺1错1颠倒不给分)
(3)脱氨基 体内缺乏分解或转化三聚氰胺的酶
Ⅱ.(10分)
(1)使胚芽鞘中不含IAA氧化酶(或使原有的IAA氧化酶分解,新的不能合成)
(2)赤霉素可以促进生长素的合成 抑制生长素的分解
(3)伸长生长 两重
31.(20分)
(1)限制性内切酶 DNA聚合酶 四种脱氧核苷酸
(2)B、C(缺1不给分)
(3)植物组织培养
(4)①正反交
②甲×丁或乙×丁
雌性抗除草剂单色耐盐植株 甲或乙
AaXbY
2009年高三二模化学试题参考答案:
6.B 7.D 8.B 9.C 10.C 11.A 12.C 13.A
26.(15分)
(1)Cl2 + 2OH- = Cl- + ClO- + H2O(3分)
(2) (2分)
(2分)
(3)Na2CO3 HCl 或NaHCO3 HCl(每空2分,共4分)
(4)C + 2H2SO4(浓)  CO2↑ + 2SO2↑ + 2H2O
CO2↑ + 2SO2↑ + 2H2O
或C + 4HNO3(浓)  CO2↑ + 4NO2↑ + 2H2O
(3分)
CO2↑ + 4NO2↑ + 2H2O
(3分)
(5)CH3CHO
+ 2Cu(OH)2  CH3COOH
+ Cu2O + 2H2O(3分)
CH3COOH
+ Cu2O + 2H2O(3分)
 27.(14分)
27.(14分)
(1) (2分)
(2)2C
+ SiO2  Si + 2CO↑(3分)
Si + 2CO↑(3分)
(3)Si3N4(2分)
(4)碱性(1分) S2-+H2O HS-+OH-(2分)
HS-+OH-(2分)
(5)金刚石、晶体硅、二氧化硅、甲烷、碳化硅(其他合理答案也可)(4分)
28.(14分)
(1)在分液漏斗中装水,关闭活塞a、b,打开分液漏斗的活塞,过一会儿,若分液漏斗内的水不能顺利流下,同时分液漏斗颈内留有一段水柱,则说明装置A不漏气。(2分)
(2)铁屑逐渐减少,有气泡产生,溶液呈浅绿色;铁与杂质铜形成原电池,加快了反应速率。(每空2分,共4分)
(3)2Fe2+ + 2H+ + H2O2 == 2Fe3+ + 2H2O(3分)
(4)加热蒸干条件下会因Fe3+水解而生成Fe(OH)3(3分)
(5)氯水。(其他合理答案也可)(2分)
29.(17分)
(1)C10H12O2(2分)。
(2) (3分)。
(3分)。
(3)① 取代反应(1分); 加成反应(1分)。
② (2分); 10(2分)。
(2分); 10(2分)。
③ CH2 = CHCH2Cl + NaOH → CH2 = CHCH2OH + NaCl (3分)
 (3分)
(3分)


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com