
题目列表(包括答案和解析)
(14分)“温室效应”是哥本哈根气候变化大会研究的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决“温室效应”的有效途径。
(1) 其中一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l) ="=" C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l) ="=" C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为 。
(2)在一定条件下,6H2(g) +2CO2(g) CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
| | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
 CH3OH(g)+ H2O(g)。2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L。下列判断不正确的是 。
CH3OH(g)+ H2O(g)。2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L。下列判断不正确的是 。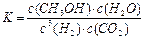
|
 CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。 | | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
 CH3OH(g)+ H2O(g)。2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L。下列判断不正确的是 。
CH3OH(g)+ H2O(g)。2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L。下列判断不正确的是 。
|
 CH3CH2OH(g)+3H2O(g).
CH3CH2OH(g)+3H2O(g).| CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
 CH3OH(g)+H2O(g).2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L.下列判断不正确的是______.
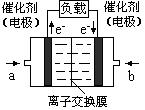
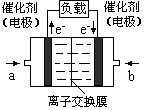
CH3OH(g)+H2O(g).2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L.下列判断不正确的是______.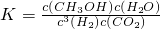 b.H2的平均反应速率为0.3mol/(L?s)
b.H2的平均反应速率为0.3mol/(L?s) 氧气”),b处电极上发生的电极反应是:______.
氧气”),b处电极上发生的电极反应是:______.| CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
 CH3OH(g)+H2O(g).2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L.下列判断不正确的是______.
CH3OH(g)+H2O(g).2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L.下列判断不正确的是______. b.H2的平均反应速率为0.3mol/
b.H2的平均反应速率为0.3mol/
| CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
 CH3OH(g)+H2O(g).2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L.下列判断不正确的是______.
CH3OH(g)+H2O(g).2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L.下列判断不正确的是______. b.H2的平均反应速率为0.3mol/
b.H2的平均反应速率为0.3mol/
评分说明:
1.本答案供阅卷评分时使用,考生若写出其它正确答案,可参照评分标准给分。
2.物理计算题只有最后答案而无演算过程的,不得分。
3.化学方程式、离子方程式未配平的,都不得分。
第I卷
第I卷共18小题,每小题6分,共108分。
一、选择题:选对的给6分,选错或未选的给0分。
1.D 2.B 3.C 4.C 5.D 6.A 7.B 8.C 9.D 10.B 11.C 12.D
二、选择题(全部选对的得6分,选对但不全的得3分,有错选或不答的得0分。)
13.D 14.B 15.B 16.ABD 17.B 18.BD
第Ⅱ卷
第Ⅱ卷必考部分共9题,共157分。
19.(18分)
(1)①只有滑动摩擦力做负功
②滑块质量 ,桌面到地面的距离
,桌面到地面的距离 ,
,

③滑块在水平桌面上通过的位移 ,
,

(2)①大 小
②闭合开关前,滑动变阻器未置于左端(其他说法正确的同样给分)
③则
④略(只连错一根导线给1分,连错两根以上导线不给分)
20.(15分)
解:(1)该队员先在 时间内以
时间内以 匀加速下滑
匀加速下滑
第 由牛顿第二定律得:
由牛顿第二定律得:
所以
(2)最大速度 代入数据解得:
代入数据解得:

(3)然后在 时间内以
时间内以 匀减速下滑
匀减速下滑
由牛顿第二定律得:

队员落地时的速度 代入数据解得:
代入数据解得:
21.(19分)
(1)A至D点,由动能定理


由牛顿第二定律


由牛顿第三定律

对管壁的压力为5mg,方向向下
(2)第一次经过C

设管壁对小球的作用力向下


 的方向向下
的方向向下
22.(20分)
参考答案及评分标准:
(1)

(2)

联立得:
(3)

(4)


联立得:
23.(15分)
(1)①
②
③
(2)
② 或
或
③制造铝合金(铝热剂或包装业或导线或炊具等合理答案均可给分)
24.(15分)
(1) (条件没写不扣分)
(条件没写不扣分)
(2) 、
、
(3) 或
或
(4)① ②18.75% (保留小数点后两位)
②18.75% (保留小数点后两位)
②B、D (少选得1分,多选或错选均不得分)
25.(15分)
(1) (浓)
(浓)

吸收 防止污染空气
防止污染空气
(2)①防止C中的液体倒吸(或检验反应时导管是否堵塞或拆卸装置前从B管口向试管A中大量鼓气,以排尽A中的 气体,不会产生污染等其他合理答案均给两分。)
气体,不会产生污染等其他合理答案均给两分。)
②生成了溶解度较大的
③试管中有气泡产生,湿润的蓝色石蕊试纸变红
 溶液,试管中出现浑浊 (其他合理答案均给分)
溶液,试管中出现浑浊 (其他合理答案均给分)
26.(25分)
I.(1)水淹时间
(2)海 互花米草采样地点
(3)3 0
(4)长期水淹互花米草无氧呼吸造成供能不足、酒精中毒
答无氧呼吸得1分, 供能不足得1分, 酒精中毒得1分
Ⅱ.(1)下丘脑 体液 ④⑤
(2)①②③
汗液分泌减少或毛细血管收缩
27.(15分)
(1)大翅
(2)分离
 发生性状分离,且分离比为3:1
发生性状分离,且分离比为3:1
(3)X

第Ⅱ卷选考部分共5题,共35分。其中,第28、29题为物理题,第30、31题为化学题,考生从两道物理题、两道化学题中各任选一题作答,若答28、29题都作答,则按第28题计分,若第30、31题都作答,则按第30题计分;第32题为生物题,是必答题。
28.(1)② (2)③
29.(1)① (2)④
30.(1)C O N
(2)
(3)配位键
(4)2
(5) 分子间能形成氢键,
分子间能形成氢键, 分子间不能形成氢键
分子间不能形成氢键
(6)1:3
31.(1)加成、取代或酯化
(2)酯基、(醇)羟基
(3)2
(4)
(5)
32.(1)限制性核酸内切酶 农杆菌转化法
(2)抗原-抗体杂交 抗虫的接种实验
(3)植物组织培养技术
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com