
题目列表(包括答案和解析)
某化学小组对一包干燥的红色粉末组成进行探究。请你参与并回答有关问题。
【教师提醒】它由Cu 、Fe2O3二种固体中的一种或两种组成。
【提出猜想】红色粉末可能的组成有:①只有Cu;
②只有 ;③是Cu 、Fe2O3的混合物。
【资料获悉】Cu在FeCl3溶液中发生反应:2FeCl3+Cu = 2FeCl2+CuCl2
【实验探究】(1)甲同学取少量红色粉末于试管中,滴加足量稀盐酸,振荡后观察,发现固体全部溶解。甲同学认为可以排除猜想中的①和③,而乙同学认为只能排除猜想①,你认为 的观点正确(填“甲”或“乙”)。
(2)丙同学为进一步确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按右下图在通风橱中进行实验。开始时缓缓通入CO气体,过一段时间后再加热使其充分反应。待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却。反应前后称量相关装置和物质的总质量,其数据如下表:
|
|
反 应 前 |
反 应 后 |
|
Ⅰ 组 |
玻璃管和红色粉末的总质量为37.3 g |
玻璃管和固体物质的总质量为36.1 g |
|
Ⅱ 组 |
洗气瓶和所盛溶液的总质量为180.0 g |
洗气瓶和瓶中物质 的总质量为183.1 g |
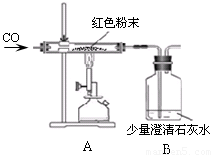
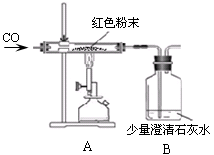
【交流讨论】
(1)在装置A中先通CO气体的作用是 。
(2)写出A装置中发生反应的化学方程式 ;实验中观察到A装置中的现象为 。
(3)为了防止溶液倒吸,本实验停止加热前是否需要先断开A和B的连接处?
不需要, 。
(答对下面(4)与【反思评价】两小题将奖励4分,但全卷总分不超过60分)
(4)选择 组的实验数据计算来确定红色粉末的组成。最终计算结果表明:该红色粉末的组成是猜想中的第 组(填序号)。(2分)
【反思评价】丁同学指出:从环保角度,上图装置有严重不足之处。你认为应该如何改进? 。 (2分)
某化学小组对一包干燥的红色粉末组成进行探究。请你参与并回答有关问题。
【教师提醒】它由Cu 、Fe2O3二种固体中的一种或两种组成。
【提出猜想】红色粉末可能的组成有:①只有Cu;
②只有 ;③是Cu 、Fe2O3的混合物。
【资料获悉】Cu在FeCl3溶液中发生反应:2FeCl3+Cu = 2FeCl2+CuCl2
【实验探究】(1)甲同学取少量红色粉末于试管中,滴加足量稀盐酸,振荡后观察,发现固体全部溶解。甲同学认为可以排除猜想中的①和③,而乙同学认为只能排除猜想①,你认为 的观点正确(填“甲”或“乙”)。
(2)丙同学为进一步确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按右下图在通风橱中进行实验。开始时缓缓通入CO气体,过一段时间后再加热使其充分反应。待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却。反应前后称量相关装置和物质的总质量,其数据如下表:
| | 反 应 前 | 反 应 后 |
| Ⅰ 组 | 玻璃管和红色粉末的总质量为37.3 g | 玻璃管和固体物质的总质量为36.1 g |
| Ⅱ 组 | 洗气瓶和所盛溶液的总质量为180.0 g | 洗气瓶和瓶中物质 的总质量为183.1 g |
某化学研究小组对当地的石灰石样品进行了研究。称取石灰石样品8g,把40g稀盐酸分四次加入样品中,测得实验数据见下表(假设石灰石样品中杂质不溶于水、不与盐酸反应,二氧化碳不溶解)。
| 实验序号 | 加入稀盐酸的质量/g | 剩余物质的质量/g |
| 第1次 | 10 | 5.5 |
| 第2次 | 10 | 3 |
| 第3次 | 10 | 1.6 |
| 第4次 | 10 | m |
(1)第4次剩余物质的质量m= g。
(2)石灰石样品中CaCO3的质量分数为 。
(3)计算稀盐酸的溶质质量分数。(计算结果保留0.1%)
【解析】(1)由第一次剩余物质质量可以看出加入10克盐酸可以溶解固体8-5.5=2.5克,而第三次只溶解了3-1.6克=1.4克,说明碳酸钙已经反应没了,剩余的1.6克即为杂质了,故第四次加入10克酸后还应该剩余1.6克,因为杂质不与盐酸反应,
(2)共8克固体,杂质为1.6克说明碳酸钙的质量为8-1.6=6.4克,故石灰石样品中CaCO3的质量分数为6.4克/8=80%
(3)可以选择第一组,反应掉碳酸钙的质量为(8-5.5)g,据此就可以计算10克盐酸中溶质的质量了,具体步骤见答案。
某化学研究小组对当地的石灰石样品进行了研究。称取石灰石样品8g,把40g稀盐酸分四次加入样品中,测得实验数据见下表(假设石灰石样品中杂质不溶于水、不与盐酸反应,二氧化碳不溶解)。
|
实验序号 |
加入稀盐酸的质量/g |
剩余物质的质量/g |
|
第1次 |
10 |
5.5 |
|
第2次 |
10 |
3 |
|
第3次 |
10 |
1.6 |
|
第4次 |
10 |
m |
(1)第4次剩余物质的质量m= g。
(2)石灰石样品中CaCO3的质量分数为 。
(3)计算稀盐酸的溶质质量分数。(计算结果保留0.1%)
【解析】(1)由第一次剩余物质质量可以看出加入10克盐酸可以溶解固体8-5.5=2.5克,而第三次只溶解了3-1.6克=1.4克,说明碳酸钙已经反应没了,剩余的1.6克即为杂质了,故第四次加入10克酸后还应该剩余1.6克,因为杂质不与盐酸反应,
(2)共8克固体,杂质为1.6克说明碳酸钙的质量为8-1.6=6.4克,故石灰石样品中CaCO3的质量分数为6.4克/8=80%
(3)可以选择第一组,反应掉碳酸钙的质量为(8-5.5)g,据此就可以计算10克盐酸中溶质的质量了,具体步骤见答案。
小明同学为测定某稀硫酸溶液浓度(即溶质质量分数),他取该稀硫酸溶液20 g,将30g氢氧化钡溶液分三次加入该稀硫酸溶液中,测得三次反应的有关数据见下表:
| 第一次 | 第二次 | 第三次 | |
| 加入氢氧化钡溶液的质量/g | 10 | 10 | 10 |
| 生成沉淀的质量/g | 0.923 | 1.864 | 2.33 |
请根据有关数据进行分析与计算:
(1)20g该稀硫酸溶液与氢氧化钡溶液完全反应时生成沉淀的质量为 g。
(2)将第三次反应后所得的混合液过滤,得到滤液的质量为 g。
(3)该稀硫酸溶液的浓度(即溶质质量分数)为多少?(写出计算过程)
(1)2.33 g(1分) (2)47.67 g(1分)
(3)(共4分,设未知数、作答和单位共0.5分,化学方程式0.5分,建立关系式1分,x结果1分,质量分数计算1分)
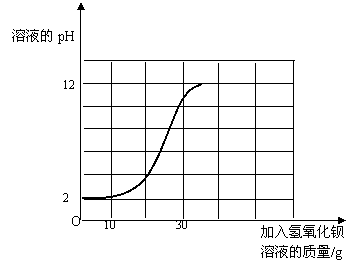
(4)小明同时用pH计测定并记录该稀硫酸溶液与氢氧化钡溶液反应过程中混合溶液pH变化情况(如下图所示),请你用虚线在图中标出该稀硫酸溶液与氢氧化钡溶液刚好完全反应时的变化点,并注明pH和所反应的氢氧化钡溶液的质量。
 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com