
题目列表(包括答案和解析)
X、Y、Z和W代表原子序数依次增大的四种短周期元素,在元素周期表中,X与Z相邻,Z与W相邻;X和Y 可组成两种化合物Y2X、Y2X2,其焰色反应均为黄色。
(1)Y2X2为 色的固体。
(2)Z在元素周期表中的位置:第 周期,第 族;ZX2属于 晶体。
(3)写出Y单质和水反应的化学方程式 ;Y2X2用在潜艇中所发生的主要反应化学方程式 。
(4)WX2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过KWX3和H2C2O4在稀硫酸酸化的环境中反应制得WX2,试写出该反应的化学方程式并配平:
;在反应中 是氧化剂(填化学式),若有1 mol H2C2O4参加反应有 mol电子转移。
X、Y、Z、W是元素周期表前四周期常见的四种元素,原子序数依次增大。X原子核外有两种形状的电子云,四种伸展方向,常温下以双原子分子存在,性质稳定;Y的单质是生活中常见的合金材料成分之一,原子核外只有一个未成对电子,Z原子的半径比X大,其基态原子最外层的p电子是该层s电子的两倍,W是最常见的黑色金属之一。
(1)Z位于元素周期表中的位置是 ,W3+的最外层电子排布式是______,X的氧化物XO2与H2O比较,熔点较高的是______ (填化学式)。
(2)加热条件下,Z的单质与足量的X的最高价氧化物的水化物的浓溶液反应,生成 Z的最髙价含氧酸,写出此反应的化学方程式 。.
(3)比较Y、W性质的活泼性 (用一个化学反应方程式表示)。
(4)2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒PM2.5。汽车尾气净化的主要原理为:2NO(g)+2CO(g)  2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。

据此判断:
该反应为 反应(放热、吸热);在T2温度下,0~2s内的平均反应速率:υ(N2)= ;
(5)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,
在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
(6)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量和质量)

X、Y、Z、W是元素周期表前四周期常见的四种元素,原子序数依次增大。X原子核外有两种形状的电子云,四种伸展方向,常温下以双原子分子存在,性质稳定;Y的单质是生活中常见的合金材料成分之一,原子核外只有一个未成对电子,Z原子的半径比X大,其基态原子最外层的p电子是该层s电子的两倍,W是最常见的黑色金属之一。
(1)Z位于元素周期表中的位置是 ,W3+的最外层电子排布式是______,X的氧化物XO2与H2O比较,熔点较高的是______ (填化学式)。
(2)加热条件下,Z的单质与足量的X的最高价氧化物的水化物的浓溶液反应,生成Z的最髙价含氧酸,写出此反应的化学方程式 。.
(3)比较Y、W性质的活泼性 (用一个化学反应方程式表示)。
(4)2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒PM2.5。汽车尾气净化的主要原理为:2NO(g)+2CO(g)  2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。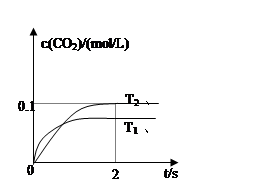
据此判断:
该反应为 反应(放热、吸热);在T2温度下,0~2s内的平均反应速率:υ(N2)= ;
(5)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,
在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
(6)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量和质量)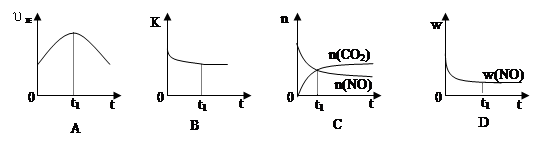
 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。

(10分)已知X、Y、Z、W是短周期中四种非金属元素,它们的原子序数依次增大。X元素原子形成的离子只有一个质子;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;Y原子的最外层电子数是内层电子数的2倍。
(1)写出下列字母所代表元素的名称:X ;Y ;Z ;W 。
(2)X单质和Z单质在一定条件下反应生成化合物E,写出该反应的化学方程式(并注明反应条件) ;Y单质和W单质(足量)在加热条件下反应生成化合物F,则F分子的空间构型为 ,电子式为 。
(3)这四种元素可组成X、Y、Z、W原子个数比为5∶1∶1∶3的化合物,该化合物的水溶液与足量浓NaOH溶液反应的离子方程式为:
___________________________________________________________________
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意。)
题号
1
2
3
4
5
6
7
8
9
答案
C
B
D
A
D
A
D
C
B
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确的给2分,但只要选错一个,该小题就为0分。)
题号
10
11
12
13
14
15
16
17
18
答案
B
D
BC
A
AD
C
BC
AC
AD
三、(本题包括3小题,共34分)
19.(12分)
(1)Fe2+ (1分)
(2)4FeCO3+O2/file:///E:\cooco.net.cn\docfiles\down\test\down\2ba40b05bbedafc4c92d1587190860dd.zip\67017\2009年广州市普通高中毕业班综合测试(一)\广东省广州市2009届高三第一次模拟考试(化学).files\image030.gif) 2Fe2O3+4CO2 (2分) 坩埚、坩埚钳 (2分)
2Fe2O3+4CO2 (2分) 坩埚、坩埚钳 (2分)
(3)K2SO4 (1分) 蒸发结晶、趁热过滤、洗涤、干燥(3分)
(4)滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液。(3分)
20.(12分)
实验操作
预期现象和结论
步骤1:取少量浸取液于试管A中,逐滴滴加0.1 mol?L-1
NaOH溶液,充分振荡,边滴加边用pH 试纸检测溶液直至pH在4~9,静置。(3分)
有红褐色沉淀产生,说明浸取液中含 Fe3+。(1分)
步骤2:用滴管将试管A中上层清液转移至试管B,向试管B中滴加过量6 mol?L-1NaOH溶液,充分振荡,静置。(2分)
有白色沉淀产生,说明浸取液中含Mg2+。(1分)
步骤3:另取少量浸取液于试管C中,滴加过量6 mol?L-1
NaOH溶液,充分振荡,静置。(2分)
有沉淀产生。
步骤4:用滴管将试管C中上层清液转移至试管D,向试管D中逐滴滴加0.1 mol?L-1HCl至足量,边滴边振荡。(2分)
有白色沉淀产生然后沉淀又溶解,说明浸取液中含 Al3+。(1分)
21.(10分)
(1)(NH4)2B4O7 + 2HCl + 5H2O = 4 H3BO3 + 2NH4Cl (2分)
(2)圆底烧瓶 (1分)
安全管(或:防止装置中压力过大而发生危险;防止冷却时发生倒吸)(2分)
(3)消除其他试剂、实验操作等因素引起的误差 (2分)
(4)32.00 (1分) 4.480 (2分)
四、(本题包括3小题,共34分)
22.(12分)
(1)32(1分)
(2)2Fe3+ + Cu = 2Fe2+ + Cu2+ (2分) 铁粉、稀硫酸(2分)
(3)酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体(2分)
(4)B (2分)
|