
题目列表(包括答案和解析)
物质结构与性质:等电子体原理是指两个或两个以上的分子(或离子),它们的原子数相同,分子(或离子)中价电子数也相同,这些分子(或离子)常具有相似的电子结构,相似的几何构型,而且有时在性质上也有许多相似之处.
(1)SiO32-、SO32-、NO3-三种离子是等电子体,三种离子的几何构型为________,其中Si、S、N三种基态原子的第一电离能大小关系为________.
(2)C2O42-和________是等电子体,C2O42-离子具有较强的还原性,它能使酸性KMnO4溶液褪色,Mn原子在元素同期表中的位置是________,外围电子构型为________.
(3)二原子14电子的等电子体共同特点是物质中都具有共价叁键,请举出相应的3个例子________(可以是分子或离子).每个分子或离子中含________个σ键,________个π键.
(4)过去生产上常以SiO2为催化剂的载体,它和近十几年来应用日广的AlPO4是等电子体,在AlPO4中P为________配位氧.SiO2的晶胞可作如下推导:先将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成Si原子,再在每两个不共面的“小立方体”中心处各放置一个Si原子便构成了晶体Si的一个晶胞,则一个硅的晶胞中有________个Si原子.再在每两个相邻的Si原子(距离最近的两个Si原子)中心联线的中点处增添一个O原子,便构成了SiO2晶胞,故SiO2晶胞中有________个Si原子,________个O原子.
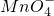 被还原成Mn2+.写出发生反应的离子方程式:______
被还原成Mn2+.写出发生反应的离子方程式:______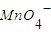 被还原成Mn2+.写出发生反应的离子方程式:______
被还原成Mn2+.写出发生反应的离子方程式:______湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com