
题目列表(包括答案和解析)
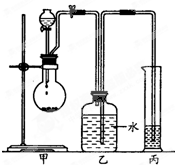 某化学小组探究液体有机物样品A(C3H8O2)的结构,进行如下实验.
某化学小组探究液体有机物样品A(C3H8O2)的结构,进行如下实验.| 实验编号 | 有机样品的体积 | 有机样品的质量 | 生成气体的体积(标准状况下) | I | 3.65mL | 3.8g | 1120mL | II | 7.30mL | 7.6g | 2240mL | III | 14.60mL | 15.2g | 4000mL |


| ||
| ||
| ||
| ||
| ||
| ||

 Al(OH)3+3H+,铝离子水解产生氢氧化铝胶体,能吸附水中悬浮物,使之沉淀下来
Al(OH)3+3H+,铝离子水解产生氢氧化铝胶体,能吸附水中悬浮物,使之沉淀下来 Al(OH)3+3H+,铝离子水解产生氢氧化铝胶体,能吸附水中悬浮物,使之沉淀下来
Al(OH)3+3H+,铝离子水解产生氢氧化铝胶体,能吸附水中悬浮物,使之沉淀下来| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 称量(取用砝 码过程) |
↓↑ ↓↑ |
↓ ↓ |
↓↑ ↓↑ |
↓ ↓ |
↓↑ ↓↑ |

 (I)滴定分析法是化学分析法中的重要分析方法之一.
(I)滴定分析法是化学分析法中的重要分析方法之一.| 滴定次数 实验数据(mL) |
1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |

| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | 木条不复燃 | 常温下过氧化氢溶液不分解(或分解很少) ? ? |
| 实验二 | 在装有H2O2溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 | 木条复燃 | Al2O3能加快H2O2溶液的分解速率 Al2O3能加快H2O2溶液的分解速率 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com