
题目列表(包括答案和解析)
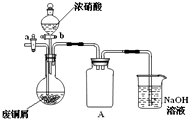 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:实验是化学研究的基础,关于下列各装置图的叙述中,正确的是
A.装置①是一套实验室制气装置,用于发生、干燥和收集气体,如铜屑与稀硝酸反应制取气体
B.装置②中,a为正极,d为阳极
C.装置③可用于收集H2、NH3、Cl2、HCl、NO2等
D.装置④能用于测量气体体积
【解析】铜屑与稀硝酸反应制取的气体是NO,NO不能用排气法收集,A错误。再电池中电流是从正极流向负极,电子是从负极流向正极,所以a是负极,b是正极,B不正确。若用来测量气体体积。则试剂瓶中必须装满水,D不正确。选项C中若收集密度大于空气的,则长进短出,若收集密度小于空气的,则短进长出,所以答案是C。
实验是化学研究的基础,关于下列各装置图的叙述中,正确的是
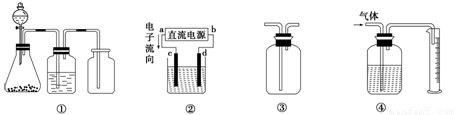
A.装置①是一套实验室制气装置,用于发生、干燥和收集气体,如铜屑与稀硝酸反应制取气体
B.装置②中,a为正极,d为阳极
C.装置③可用于收集H2、NH3、Cl2、HCl、NO2等
D.装置④能用于测量气体体积
【解析】铜屑与稀硝酸反应制取的气体是NO,NO不能用排气法收集,A错误。再电池中电流是从正极流向负极,电子是从负极流向正极,所以a是负极,b是正极,B不正确。若用来测量气体体积。则试剂瓶中必须装满水,D不正确。选项C中若收集密度大于空气的,则长进短出,若收集密度小于空气的,则短进长出,所以答案是C。
(1)分别向盛有等量铜片的四支试管中加入等体积的①浓硫酸②稀硫酸③浓硝酸④稀硝酸,能随即发生剧烈反应的是(填序号,下同)________,常温下缓慢反应(或微热后能发生剧烈反应)的是________,常温下不反应,但加热后发生剧烈反应的是________,加热也不发生反应的是________.由此可以得到上述四种酸氧化性由强到弱的顺序是:________.
(2)工业上用洗净的废铜屑作原料来制备硝酸铜.为了节约原料和防止污染环境,宜采取的方法是________(填序号)
A.Cu+HNO3(浓)![]() Cu(NO3)2
Cu(NO3)2
B.Cu+HNO3(稀)![]() Cu(NO3)2
Cu(NO3)2
C.Cu CuO
CuO Cu(NO3)2
Cu(NO3)2
D.Cu CuSO4
CuSO4 Cu(NO3)2
Cu(NO3)2
(3)先将铜与浓硫酸反应产生的气体X持续通入下图装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括________
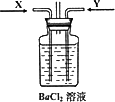
A.通入X气体后产生白色沉淀
B.通入X气体后溶液中无明显现象
C.通入Y气体后开始沉淀
D.通入Y气体后沉淀溶解
E.通入Y气体后溶液中无明显现象
由此可得到的结论是:________
A.HNO3的酸性比H2SO4强
B.盐酸的酸性比H2SO3强
C.BaSO3能溶于盐酸
D.HNO3能氧化H2SO3(或SO2)
E.BaSO4不溶于水也不溶于HNO3溶液
Ⅰ以下是有关SO2、Cl2的性质实验.
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质.
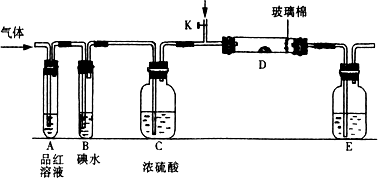
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?________(填“相同”或“不相同”);若装置D中装的是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为________.
②SO2通入B中,溶液颜色退去,则该反应的离子方程式为________.
(2)某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量(填字母)________,仍然无法观察到沉淀产生.
A.氨水
B.稀盐酸
C.硝酸钾溶液
D.硫化钠溶液
(3)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生.写出Cl2与含X的溶液反应的离子方程式________.
(4)某科研单位利用电化学原理用SO2来制备硫酸,装置如图,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.通入SO2的电极为________极,其电极反应式为________;电池的总反应式________

Ⅱ实验是化学研究的基础,关于下列各装置图的叙述正确的是________(填序号)
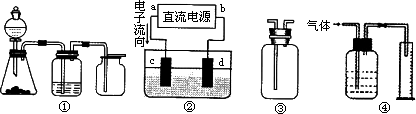
A.装置①可完成多种气体的发生、净化和收集,如铜屑与稀硝酸反应
B.装置②中,a为正扳,d为阳极
C.装置③可用于收集H2、NH3、Cl2,、HCl、NO2等
D.装置④能用于测量气体体积
Ⅲ用铅蓄电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中正确的是________(填序号)
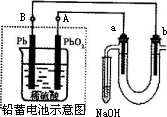
A.铅蓄电池负极的反应式为:Pb-2e-=Pb2+
B.铅蓄电池放电时,B极质量减轻,A极质量增加
C.铅蓄电池充电时,A极应与外电源负极相连
D.电解苦卤水时,a电极首先放电的是Br-
第I卷(必做,共88分)
一、选择题(本题包括15小题,每小题4分,共60分)
1―5 CDCBB 6―10 ACBAC 11―15 CCBDD
二、选择题(本题包括7小题,每小题给出的四个选项中,有的只有一个选项正确,有的有多个选项正确,全选对的得4分,选对但不全的得2分,有选错的得0分)
16.C 17.B 18.AB 19.A 20.D 21.BC 22.AD
第II卷(必做120分+选做32分,共152分)
[必做部分]
.files/image162.gif) 23.(12分)
23.(12分)
(1)图线如图所示,9.4~9.6
(2)由.files/image164.gif) 得:
得:.files/image166.gif) 由此可知,
由此可知,
图线不过原点,只有当.files/image168.gif) 很大时,才近似有
很大时,才近似有
.files/image170.gif) ,本实验达不到这一条件,故图线不过原点。
,本实验达不到这一条件,故图线不过原点。
(3)0.033 0.032
24.(15分)
解:(1)车停止运动后取小物块为研究对象庙其到达车右端时的速度为v1,
由动能定理得.files/image172.gif) ①
①
解得:.files/image174.gif) ②
②
刚进入圆轨道时,设物块受到的支持力为N,由牛顿第二定律得:
.files/image176.gif) ③
③
由牛顿第三定律.files/image178.gif) ④
④
由①③④得.files/image180.gif) ,方向竖直向下。 ⑤
,方向竖直向下。 ⑤
(2)若小物块能到达圆轨道最高点,则由机械能守恒:
.files/image182.gif) ⑥
⑥
解得:.files/image184.gif) ⑦
⑦
恰能过最高点的速度为v3
.files/image186.gif) ⑧
⑧
因.files/image188.gif) ,故小物块从圆轨道最高点做平抛运动,
,故小物块从圆轨道最高点做平抛运动,
.files/image190.gif) ⑨
⑨
.files/image192.gif) ⑩
⑩
由⑦⑨⑩联立解得x=
故小物块距车左端.files/image194.gif) (11)
(11)
评分标准:①③⑥⑨每式2分,其余每式1分。
25.(18分)
解:(1)取导体框为研究对象,从t0时刻开始拉力恒定,故电路中电流恒定,设ab边中电流为I1,cd边中电流为I2,
由受力平衡:.files/image196.gif) ①
①
.files/image198.gif) ②
②
.files/image200.gif) ③
③
解得:.files/image202.gif) ④
④
(2)设总电流为I,由闭合路欧姆定律:.files/image204.gif) ⑤
⑤
.files/image206.gif) ⑥
⑥
.files/image208.gif) ⑦
⑦
I1+I2=I ⑧
而.files/image210.gif)
解得:.files/image212.gif) ⑨
⑨
(3)由电动机的牵引功率恒定
P=F?v ⑩
对导体棒:.files/image214.gif) (11)
(11)
由以上各式联立解得:.files/image216.gif) (12)
(12)
评分标准:①⑤⑨⑩(11)(12)每式2分,其余每式1分。
.files/image217.gif) 26.(16分,除注明外,每空2分)
26.(16分,除注明外,每空2分)
.files/image218.gif)
.files/image219.gif)
.files/image220.gif)
(1)基因
(2)BbXAXa
BbXAY
(3)1/4
(4)实验假设:亲代雌鼠生殖细胞中X染色体上的基因出现了隐性突变(或雌鼠正常尾性状是由环境引起的)
实验思路:选择该正常尾雌鼠与弯曲尾雄鼠杂交(或者与正常尾雄鼠杂交),观察后代正常尾和弯曲尾出现的比例。
预期结果:若后代雌性都是弯曲尾,雄性都是正常尾,则证明是亲代雌鼠生殖细胞中X染色体上的基因出现了隐性突变;若后代全是弯曲尾或者只有雄性出现正常尾,雌性都是弯曲尾,则证明雌鼠正常尾性状是由环境引起的。(或者若后代都是正常尾,则证明是亲代雌鼠生殖细胞中X染色体上的基因出现了隐性突变;若后代雌雄全是弯曲尾或雌雄中正常尾、弯曲尾都有,则证明雌鼠正常尾性状是由环境引起的)(4分)
27.(17分,除注明外,每空2分)
(1)光反应速度比暗反应快
(2)下降 上升
(3)光反应释放O2的速率等于暗反应吸收CO2的速率 >
(4)①阻止有机物进出叶片 ②呼吸作用消耗有机物的速率
③生产速率.files/image222.gif) (3分)
(3分)
|